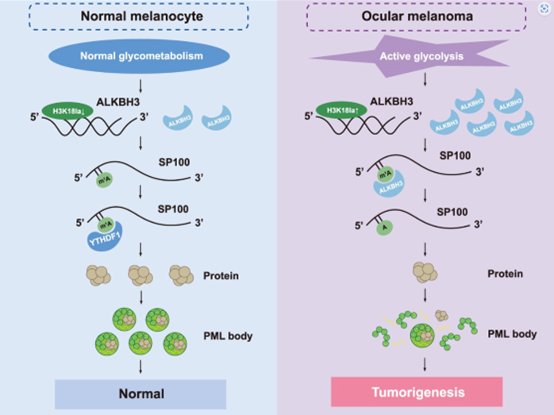
尽管N1-甲基腺苷(m1A)RNA修饰是RNA代谢的重要调节因子,但m1A修饰在肿瘤发生中的作用仍不清楚。
2023年12月1日,上海交通大学柴佩韦、范先群及贾仁兵共同通讯在 Nucleic Acids Research 上在线发表题为“Histone lactylation-boosted ALKBH3 potentiates tumor progression and diminished promyelocytic leukemia protein nuclear condensates by m1A demethylation of SP100A”的研究论文,该研究发现组蛋白乳糖化通过去除SP100A的m1A 甲基化,增强ALKBH3的表达,同时减弱肿瘤抑制性早幼粒细胞白血病蛋白(promyelocytic leukemia protein,PML)凝聚体的形成,促进癌症的恶性转化。
首先,ALKBH3在高风险的眼部黑色素瘤中由于组蛋白乳糖基化水平过高而特异性上调,即m1A 低甲基化状态。此外,多组学分析方法随后确定了PML小体的核心成分SP100A作为ALKBH3的下游候选靶标。
在治疗方面,ALKBH3的沉默在体外和体内都对黑色素瘤表现出有效的治疗效果,并且可以被SP100A的敲除所逆转。在机制上,该研究发现YTHDF1负责识别m1A 甲基化的SP100A转录本,从而增加其RNA稳定性和翻译效率。总之,该研究初步证明了m1A 修饰是肿瘤抑制基因表达所必需的,扩展了目前对m1A 在肿瘤进展中动态功能的理解。此外,乳糖基化驱动的ALKBH3对于PML核凝聚体的形成至关重要,这为理解m1A 修饰、代谢重编程和相分离事件架起了桥梁。
RNA修饰由多种酶修饰或去除,这些修饰在基本的分子机制中发挥作用。N1-甲基腺苷(m1A)RNA修饰的精确时空调控对于表观基因组稳态至关重要。重要的是,m1A RNA甲基化阻断了Watson-Crick界面,从而影响RNA二级结构和蛋白质- RNA相互作用,这在tRNA,rRNA,mRNA和线粒体RNA中观察到。m1A动态甲基化由甲基转移酶(TRMT6、TRMT61A、TRMT61B和TRMT10C)、去甲基化酶(ALKBH1和ALKBH3)和RNA结合蛋白(YTHDFs)介导。迄今为止,越来越多的证据表明,m1A动态甲基化在基因表达、RNA稳定性和翻译效率等生物学过程中起着至关重要的作用。例如,ALKBH3介导的m1A去甲基化对于Aurora A的表达是必需的,它调节哺乳动物细胞中的纤毛发生。
值得注意的是,m1A甲基化参与多种癌症的发生,包括胃肠道癌、口腔鳞状细胞癌、宫颈癌和霍奇金淋巴瘤。此外,异常的m1A甲基化引发了一些致癌事件,包括代谢重编程、胶原蛋白的产生和tRNA来源的小RNA的产生。值得注意的是,m1A去甲基化酶ALKBH3的表达增加在许多癌症中经常被观察到,并加速了恶性增殖和侵袭。值得注意的是,几项全基因组筛选研究已经证明了具有超过500个显著的m1A结合位点;然而,这些m1A甲基化修饰在肿瘤发生中的潜在功能仍然知之甚少。
文章模式图(图源自Nucleic Acids Research)
眼部黑色素瘤包括结膜黑色素瘤(CoM)和葡萄膜黑色素瘤(UM),是最常见和最危及生命的眼部恶性肿瘤,对普通化疗耐药。对于CoM、BRAF和NRAS的功能获得性突变已被确定为驱动致癌事件。大多数UM患者存在G蛋白α亚基Q(GNAQ)和G蛋白α亚基11(GNA11)的激活突变。此外,一些表观遗传学异常参与了眼部黑色素瘤的发病机制,包括异常的组蛋白修饰、m6A修饰和3D染色体构象。例如,ALKBH5介导的m6A去甲基化抑制组氨酸三联体核苷酸结合蛋白2(HINT2)的翻译,从而促进眼部黑色素瘤细胞的恶性增殖和转移。然而,m1A修饰在眼部黑色素瘤发生中的作用机制仍不清楚。
基于此,该研究首次揭示了在眼部黑色素瘤中,全局性m1A修饰特异性降低,这归因于组蛋白乳糖化增加了ALKBH3的表达。此外,研究人员还进行了全基因组蛋白质组学分析、转录组筛选和m1A甲基化RNA免疫沉淀测序(MeRIP-seq),发现ALKBH3可以去除SP100A上的m1A修饰并抑制其表达。重要的是,ALKBH3的沉默在体外和体内都对黑色素瘤表现出良好的治疗效果,并且这些效果随着SP100A的敲除而减弱。此外,YTHDF1负责识别SP100A的m1A修饰,从而增强其RNA稳定性和翻译效率。总的来说,该结果表明ALKBH3依赖的m1A去甲基化对于PML核体的形成至关重要,从而提供了一种新的治疗策略,其中“靶向m1A重编程策略”对于肿瘤治疗是有效的。
吉满助力
本研究中所用的ALKBH3/SP100A过表达和干扰慢病毒质粒、SP100A-5UTR报告基因质粒均由吉满生物提供。
了解更多质粒构建,病毒包装,稳转株构建,敲除细胞株,报告基因检测等相关服务。欢迎访问吉满生物官网:www.genomeditech.com
免费咨询电话:400-627-9288
文章来源:课题组供稿
文献来源
https://doi.org/10.1093/nar/gkad1193
原文引用
“The PGMLV-CMV-MCS-EF1-ZsGreen1-T2A-Puro,PGMLV-hU6-MCS-CMV-ZsGreen1- PGK- Puro-WPRE,ZV502 and ZV102 vectors were used in our study. ALKBH3 shRNAs,SP100A shRNA,YTHDF1 shRNA and their corresponding verified negative control sequences were amplified by PCR and inserted into the PGMLV-hU6-MCS-CMV-ZsGreen1-PGK- Puro-WPRE vectors. The SP100A ORF was generated by PCR and cloned into the PGMLV-CMV-MCS-EF1-ZsGreen1-T2A-Puro vector.
The DNA fragments of the SP100A-5UTR containing the wild-type m1A motifs and mutant motifs (potential m A was replaced by T) were synthesized and inserted upstream of firefly luciferase of the pmirCLO vector.”