研究背景
胶质母细胞瘤(Glioblastoma,GBM) 是最常见和恶性的原发性脑肿瘤,中位生存期小于15个月,恶性程度高。胶质瘤中重要的细胞,胶质瘤干细胞(GSCs),是一类可以自我更新、分化、维持肿瘤异质性、与肿瘤生长和治疗耐药性紧密相关的细胞。阐明GSCs调控的分子机制将扩大我们对疾病的认识,并为靶向GBMs的有效治疗策略提供参考。
RNA修饰是控制转录调控的基本机制。核糖2'-O-Me甲基化是人类rRNA中最丰富的修饰,有100多个位点被标记。人rRNA 2'-O-Me由C/D box小核仁核糖核蛋白snoRNPs)复合物(介导,该蛋白复合物由C/D box snoRNA、甲基转移酶原纤维蛋白(FBL)和RNA结合蛋白NOP58(NOP58核糖核蛋白)、NOP56和NHP2L19组成。rRNA修饰在核糖体的生物发生和致癌蛋白的翻译调节中发挥重要作用,以调节多种细胞功能,包括肿瘤发生过程中的细胞增殖、生存和转化。然而,关于rRNA 2'-O-Me在癌症干细胞,特别是GSCs中的作用,大家知之甚少。
文献来源
2023年11月,中国科学院/中国科学院大学/北京神经外科研究所/首都医科大学/西湖大学/西湖实验室与美国匹兹堡大学医学中心研究团队通过Nature Communications期刊在线发表了题为“LncRNA INHEG promotes glioma stem cell maintenance and tumorigenicity through regulating rRNA 2’-O-methylation”的研究论文 ,发现了一种GSC特异性的lncRNA INHEG,它与NOP58相互作用,促进NOP58 类泛素化修饰和下游rRNA 2'-o-甲基化。这一过程支持GSC自我更新和肿瘤发生,提供了对癌症干细胞中rRNA甲基化的进一步了解,并为致命癌症提供了潜在的治疗靶点。
研究结果
rRNA 2'-o-甲基化参与GSCs的自我更新并发挥重要功能
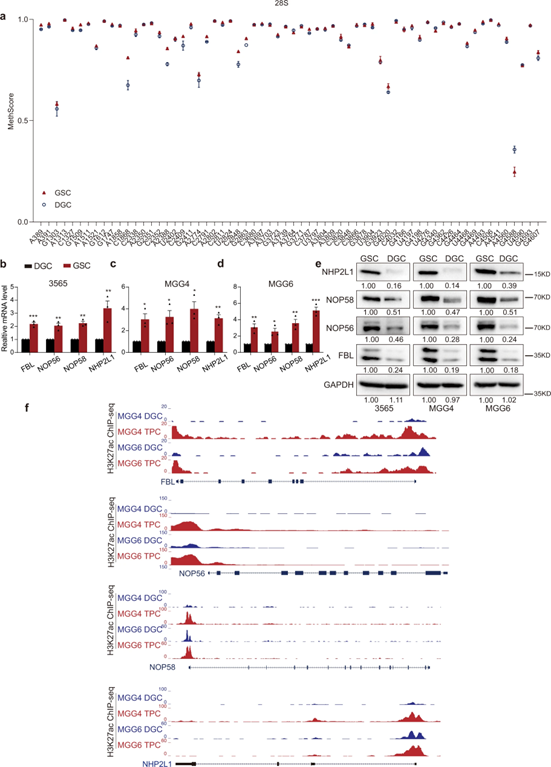
为了研究rRNA甲基化在肿瘤层次中的作用,作者通过RiboMeth-seq技术检测了人类患者来源的GSCs(3565和MGG4)和匹配的DGCs中rRNA 2'-OMe水平。
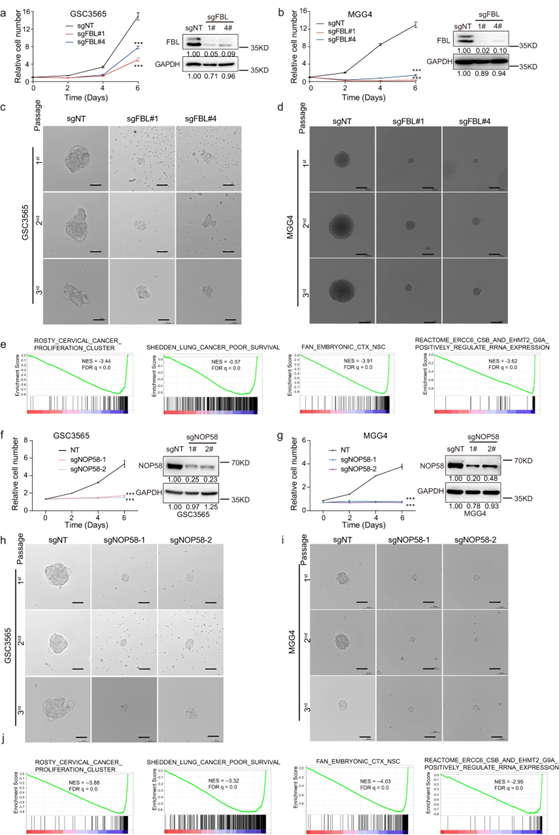
结果显示,与分化的肿瘤细胞相比,rRNA 2'-O-Me以及C/D box snoRNP蛋白组分(含FBL, NOP56, NOP58和NHP2L1)在GSCs中都更丰富。进一步用CRISPR-Cas9技术敲除了人类患者来源的GSCs中FBL和NOP58蛋白,减少了细胞生长和抑制了球体的形成;转录组测序技术差异表达基因分析表明,FBL或者NOP58调控的基因与癌症增殖、低存活率、神经干细胞和rRNA表达有关。也就是说,rRNA 2'-o-甲基化调控因子有助于GSC的自我更新和生长。
图1 rRNA 2'-O-Me参与GSCs的自我更新
图2 rRNA 2'-O-Me调节因子对GSCs的功能至关重要
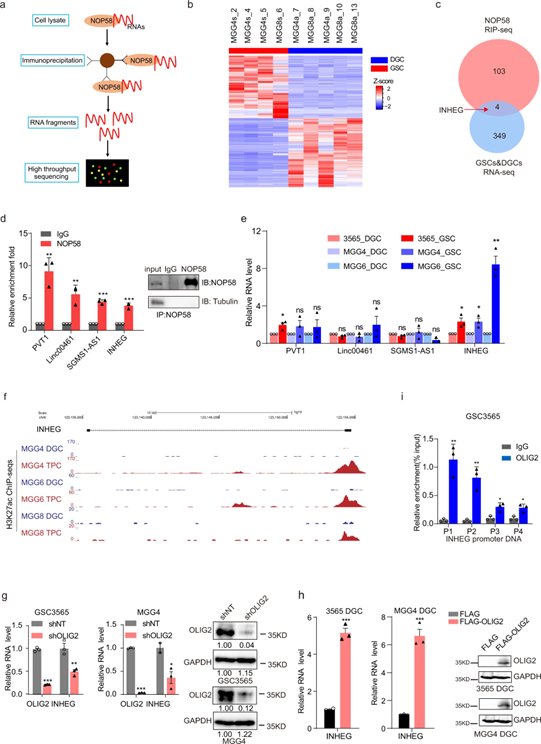
LncRNA INHEG在GSCs中高表达,并与NOP58相互作用
由于NOP58被认为是招募box C/D snoRNAs所需的RNA结合蛋白,于是作者使用紫外交联免疫沉淀和RNA测序(uvRIP-seq)技术找到并鉴定了与NOP58相互作用的一种新的lncRNA—INHEG分子,由2个外显子组成,长650bp,主要定位于细胞核,在GSCs中高表达。
图3 LncRNA INHEG与NOP58相互作用,在GSCs中高度表达
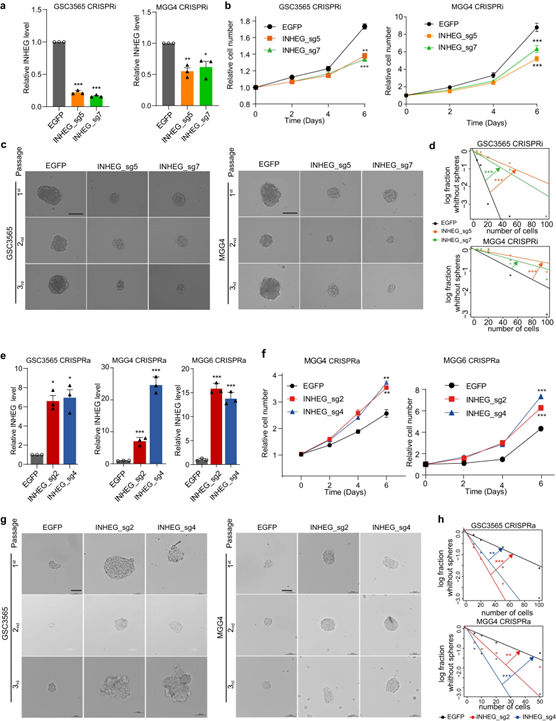
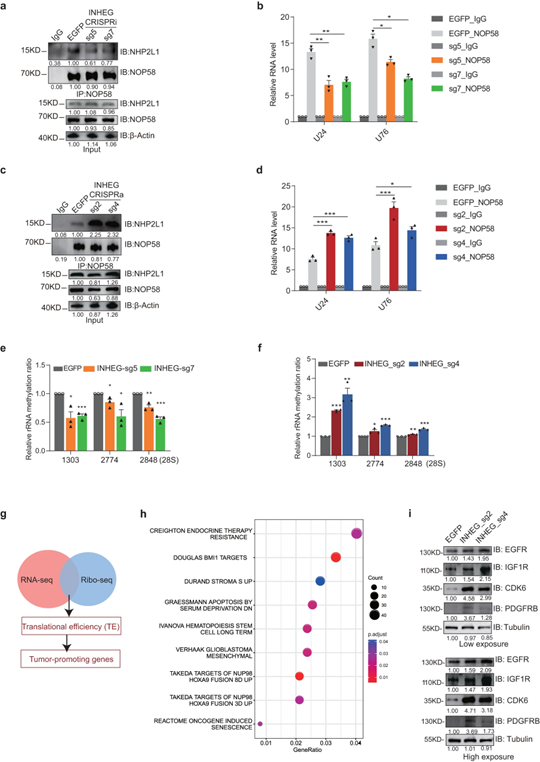
随后,作者探索了INHEG在GSC自新生维持中的细胞功能,沉默INHEG(CRISPRi)会抑制GSC的增殖,减少肿瘤球的形成;INHEG激活(CRISPRa)的GSCs的肿瘤球形成增加,表明INHEG促进GSC的增殖和自我更新。
图4 INHEG促进GSCs的自我更新和胶质瘤的发生
INHEG通过调控C/D box snoRNPs组装和rRNA 2'-o甲基化状态来调控多个癌基因的蛋白合成
INHEG与NOP58相互作用的观察表明,INHEG可能调控snoRNP的组装和功能。
为了探讨INHEG在C/D box snoRNP生物发生中的作用,在INHEG下调和上调的胶质瘤细胞中进行NOP58免疫沉淀,INHEG的转录抑制减弱了NOP58和NH2PL1之间的联系,过表达INHEG加强了NOP58与NH2PL1和snoRNA相互作用的效率,从而促进了C/D box snoRNPs的形成。此外,过表达INHEG导致rRNAs 2'-O-methylation水平升高,沉默反之。
利用RNA-seq和核糖体分析(Ribo-seq)技术进一步评估了INHEG对蛋白质合成的影响。其中,INHEG过表达后提高了1000多个基因的翻译效率,这些基因主要参与了肿瘤发生和干细胞特性。后续验证中,检测到INHEG激活增强了癌基因IGF1R、EGFR、CDK6和PDGFRB的蛋白表达,提示INHEG可能促进胶质瘤发生过程中癌基因的翻译过程。
图5 INHEG促进rRNA 2'-o-Me复合物的组装,rRNA的2'-o-Me和蛋白质从头合成
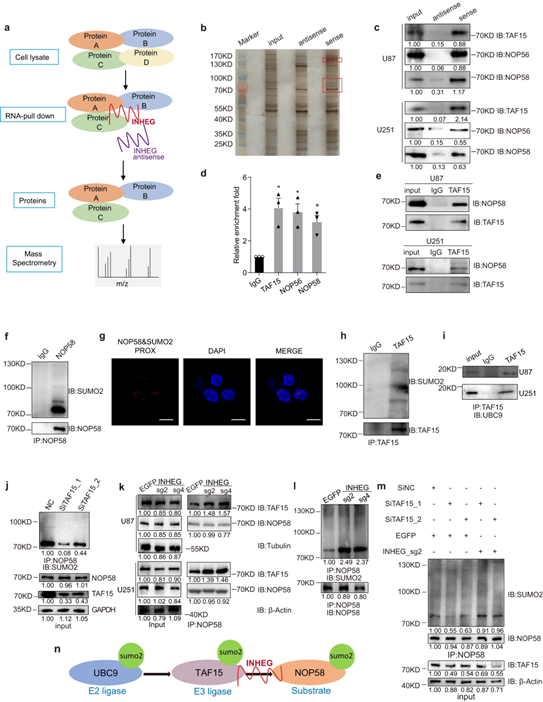
INHEG相关蛋白TAF15与NOP58相互作用,并作为NOP58的SUMO2 E3连接酶
作者进一步构建了生物素标记探针,并通过RNA pull-down、质谱(MS)联合证实了INHEG与3个蛋白(TAF15、NOP56和NOP58)之间的相互作用。在这三者关系当中,lncRNA INHEG通过结合NOP58和TAF15(作为SUMO2 E3连接酶)增强了TAF15-NOP58的相互作用,导致了NOP58的类泛素化。
图6 INHEG增强了TAF15和NOP58之间的相互作用,并以TAF15依赖的方式调控NOP58的类泛素化修饰
rRNA 2' -O-Me调控因子促进神经胶质瘤的发生
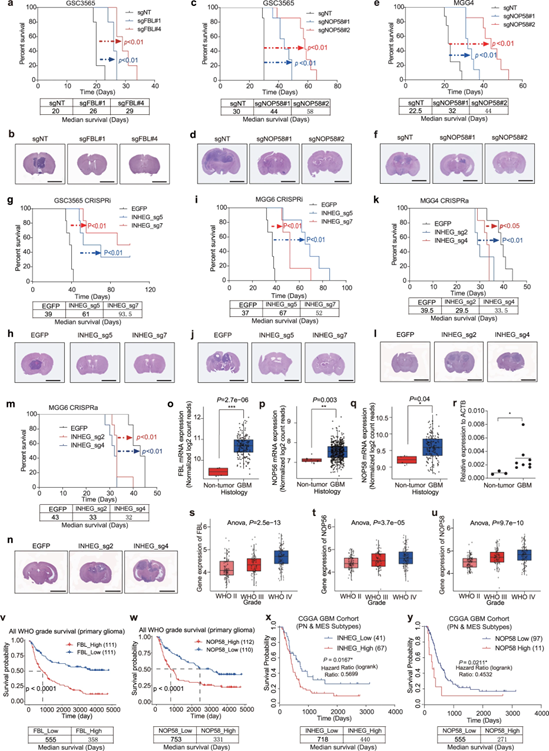
为了探索rRNA 2'-o-me调节因子对体内肿瘤生长的作用,通过FBL或NOP58敲除GSCs建立原位异种移植小鼠模型。与对照组相比,FBL或NOP58敲除的GSCs存活时间更长,肿瘤大小更小。与此同时,INHEG缺失的GSCs小鼠的生存时间更长,肿瘤质量减少。INHEG激活显示出更短的生存期,且肿瘤肿块更大。
图7 FBL、NOP56、NOP58和INHEG在胶质瘤发生中的作用
综上所述,本研究表明rRNA 2'-O-Me在GSCs的自我更新维持中是一个重要的事件。lncRNA INHEG不仅与NOP58相互作用,而且在GSCs中也高表达。INHEG通过增强TAF15与NOP58相互作用,以及C/D box RNP组装、rRNA甲基化和蛋白质的重新合成,进而促进GSCs下游的自我更新,从而促进NOP58 sumoylation。这一轴可能为胶质母细胞瘤的治疗提供了策略。
吉满助力
本研究中所用的慢病毒浓缩试剂盒由吉满生物提供。
了解更多质粒构建,病毒包装,稳转株构建,敲除细胞株,报告基因检测等相关服务。欢迎访问吉满生物官网:www.genomeditech.com
免费咨询电话:400-627-9288
文献原文
https://doi.org/10.1038/s41467-023-43113-5
原文引用
"Lentiviral particles were collected 48h after media change and concentrated using the lentivirus concentrated kit (Genomeditech) according to the manufacturer’s instructions."
声明:此推文仅代表作者个人观点,如有不科学之处,联系小编敬请指正!