研究背景
众所周知,自身免疫性疾病是一类免疫系统过度激活,从而导致靶器官损伤的疾病。CD4+T细胞是介导适应性免疫以应对外部病原体的关键细胞,通过快速增殖和分化为效应亚群(如Th1细胞和Th17细胞)促进自身免疫性疾病的进展。
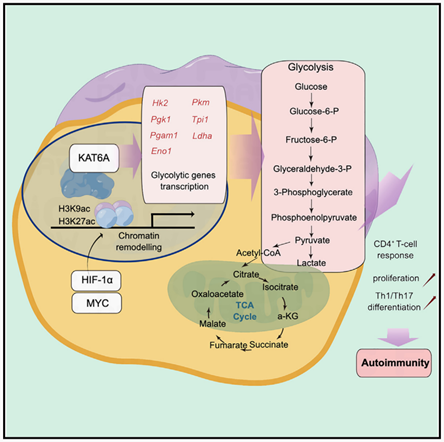
近年来,对表观遗传学的研究揭示了CD4+T细胞与自身免疫的关联。赖氨酸乙酰化是一种重要的表观遗传学修饰,能改变赖氨酸残基上的电荷,改变基因和蛋白质结构,从而在转录后水平决定基因表达和蛋白质稳定性,以响应细胞内的信号转导。赖氨酸乙酰化的动态变化是由赖氨酸乙酰转移酶(KATs)和赖氨酸去乙酰化酶的酶活性协调的。目前已有多种靶向KATs的抑制剂被开发出来,对临床应用产生了重要影响。然而,KATs在效应T细胞中的调控网络及其对自身免疫性疾病靶向治疗的临床意义仍有待进一步研究。
文献来源
日前,上海九院郑凌艳教授团队联合段胜仲教授团队在Cell Metabolism杂志上发表有关CD4+T细胞糖代谢重编程与自身免疫疾病的文章(Lysine acetyltransferase 6A maintains CD4+ T cell response via epigenetic reprogramming of glucose metabolism in autoimmunity),揭示了相关表观遗传分子在自身免疫疾病中的全新机制。
自身免疫疾病是由免疫细胞自发性激活导致的一大类疾病。包括舍格伦综合征(Sjogren’ Syndrome, SS)、系统性红斑狼疮(Systematic)和多发性硬化症等,受到风湿免疫科等临床科室的密切关注。CD4+T细胞的异常激活、分化和浸润是导致上述自身免疫疾病发生的中枢性细胞。在CD4+T细胞受到抗原刺激后,会呈现糖酵解、氧化磷酸化等代谢途径的大幅上调。
研究团队长期关注于T细胞代谢稳态在此类疾病中的作用,并在近期将目光关注到表观遗传调控失衡对T细胞糖脂代谢的潜在影响,以进一步探明驱动CD4+T细胞异常免疫应答,诱发自身免疫疾病的分子调控网络。
研究结果
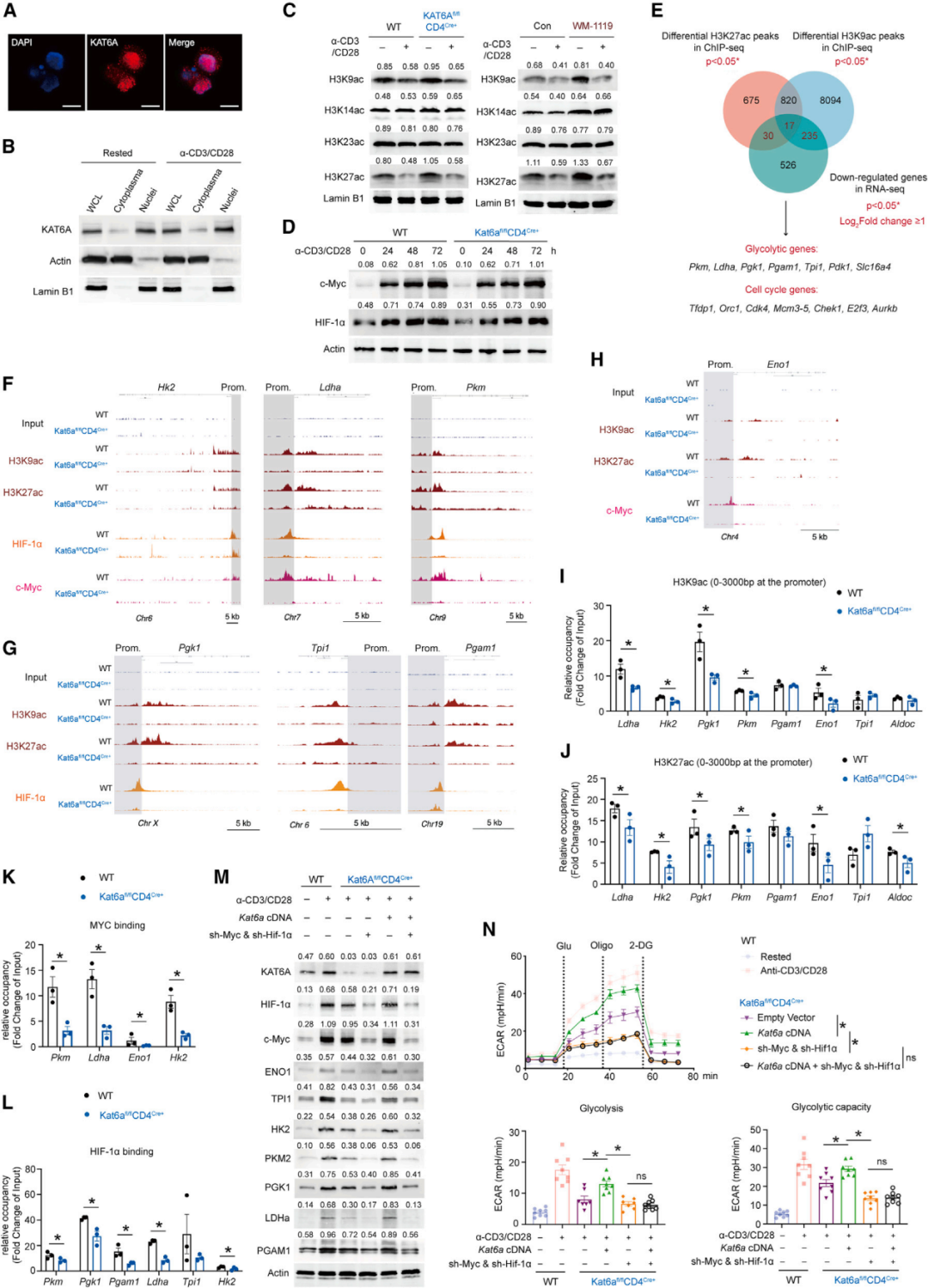
研究团队比对了SS患者的临床样本,通过测序外周血中各类淋巴细胞亚型的各类表观遗传分子表达,发现名为组蛋白乙酰转移酶6A (Lysine acetyltransferase 6A,KAT6A)的表观遗传分子与CD4+T细胞的浸润密切相关。
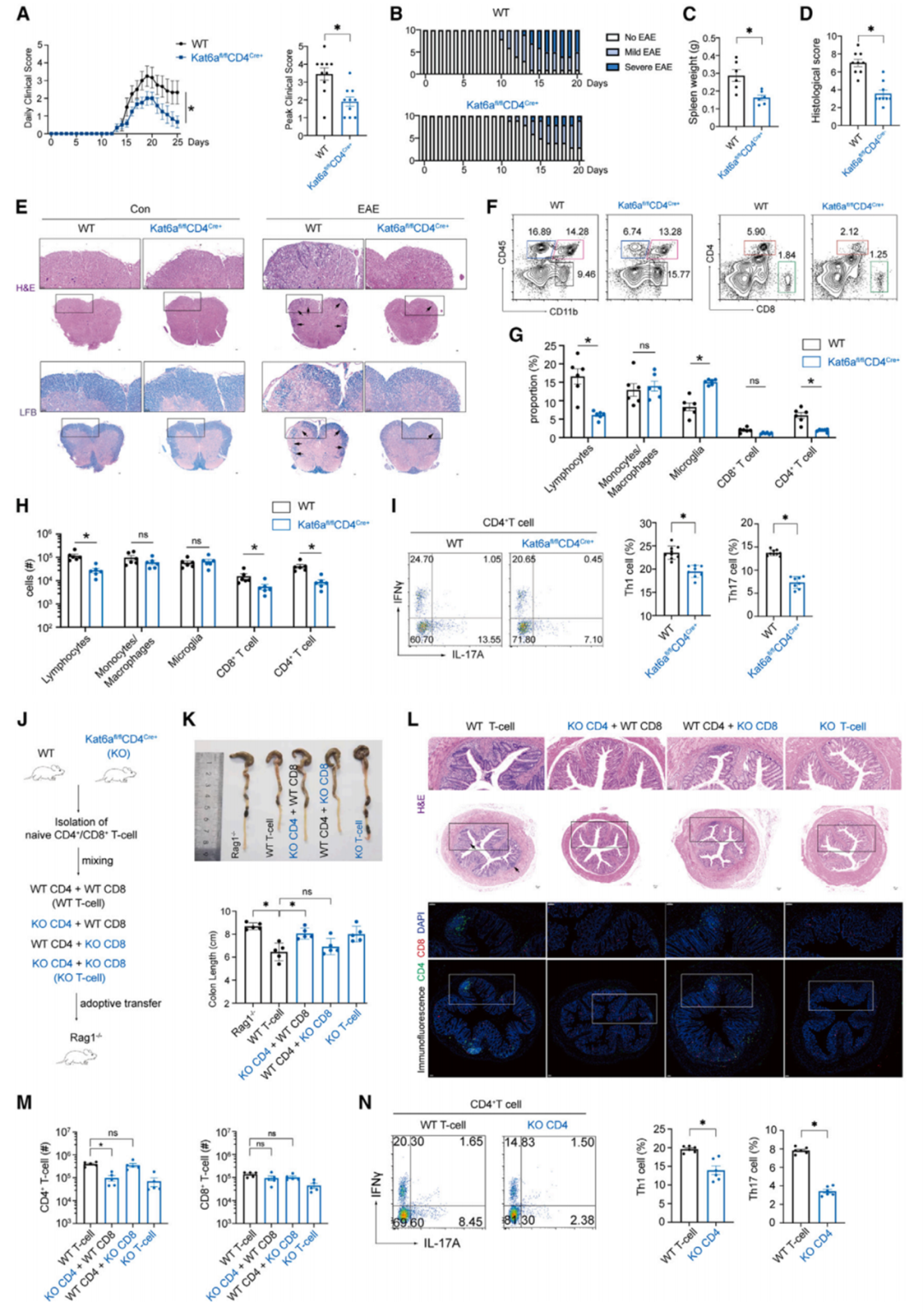
通过构建KAT6A特异性敲除的转基因小鼠,发现KAT6A缺失抑制了CD4+T细胞的过度增殖和异常分化,并能一定程度上缓解自身免疫性组织器官损伤。将KAT6A敲除的CD4+T细胞过继性转移到免疫缺陷小鼠中,发现CD4+T细胞介导的免疫应答受到显著影响。
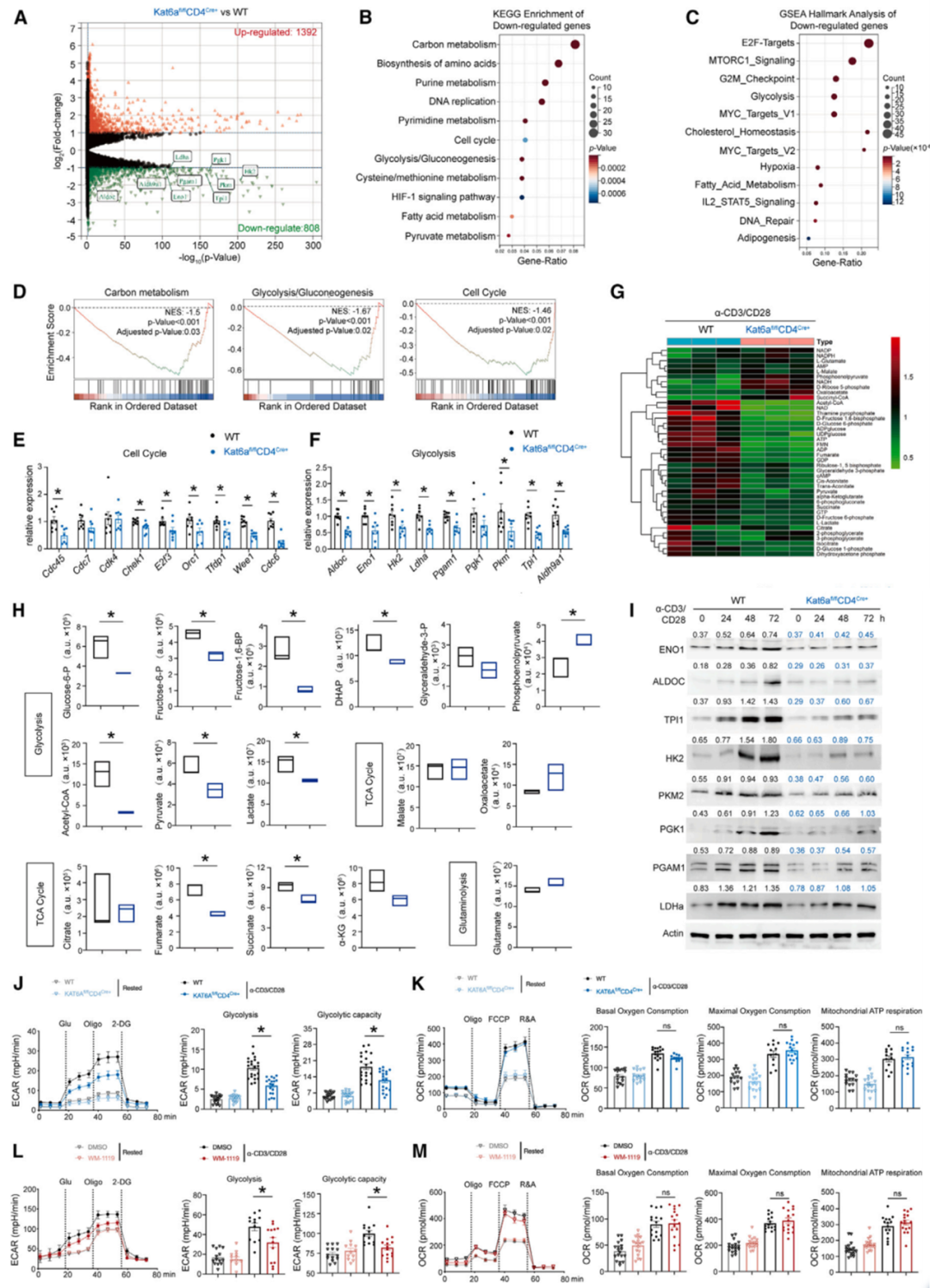
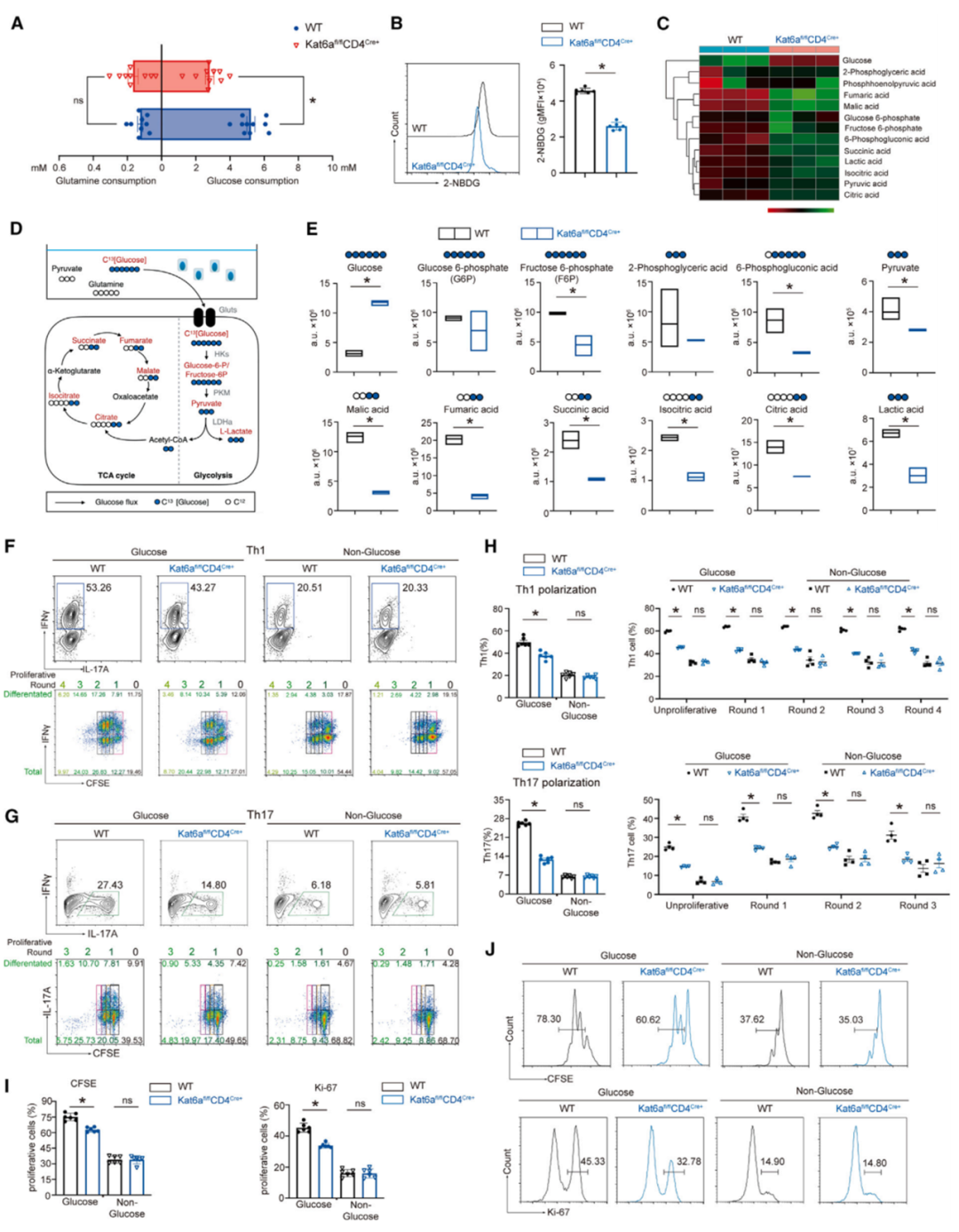
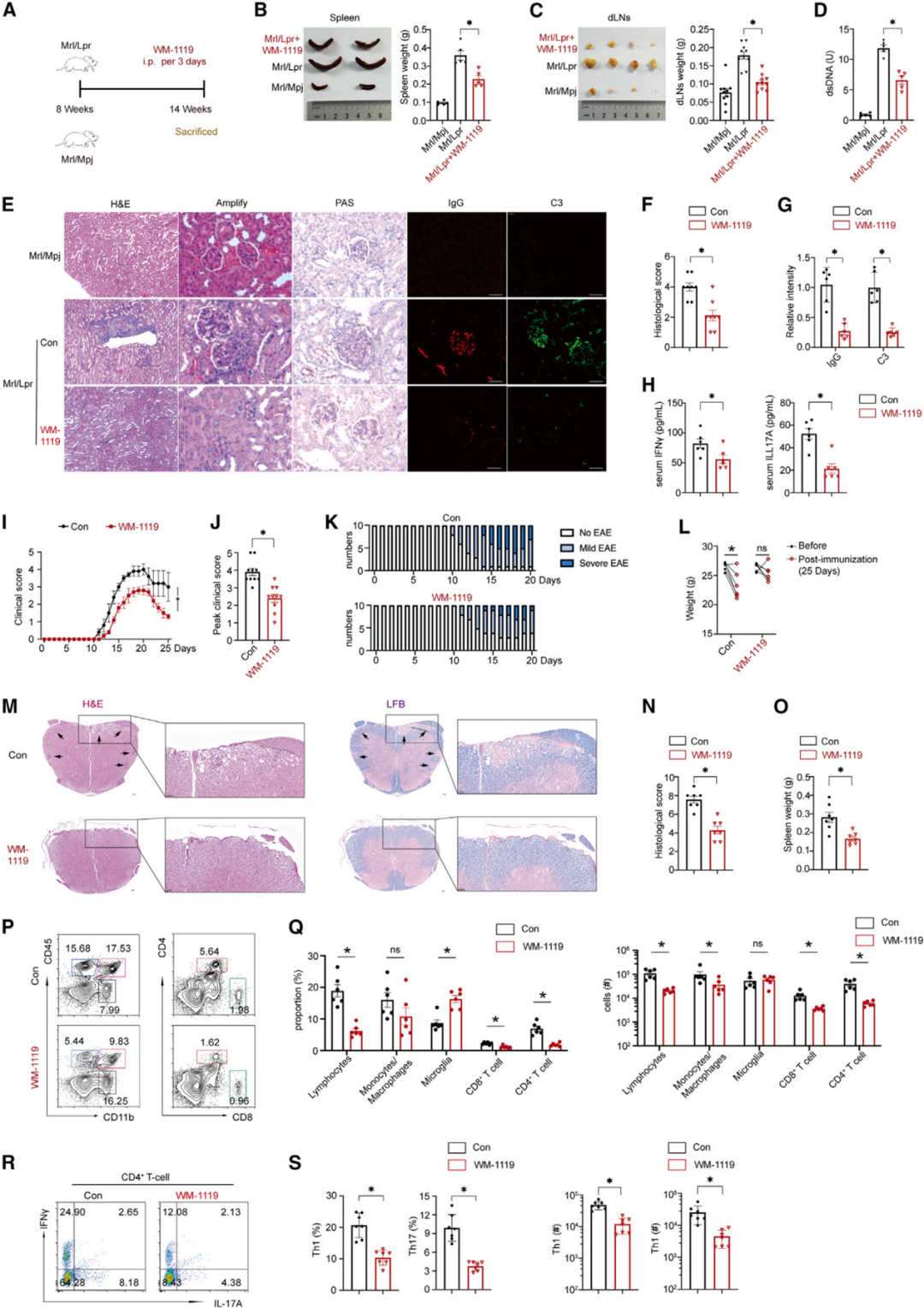
细胞层面,团队通过RNA-seq、靶向代谢组学、C13同位素代谢流检测等方法,发现KAT6A主要影响了CD4+T细胞的糖代谢,进而调控细胞的免疫应答。分子机制上,申请人通过ChIP-seq、ATAC-seq和RNA-seq进行多组学联合分析,发现KAT6A影响了多个糖代谢基因(如Hk2、Pkm、Ldha、Tpi1等)启动子的组蛋白乙酰化丰度,决定了相关基因的转录活性。最后,团队通过KAT6A的小分子抑制剂对数个自身免疫疾病模型进行干预,在动物模型中探讨了相关靶向治疗的潜在应用价值。
研究数据
Fig1 KAT6A特异性敲除小鼠不易患自身免疫病
Fig2 KAT6A缺乏会导致CD4+T细胞代谢表型紊乱
Fig3 KAT6A通过葡萄糖代谢调节CD4+T细胞的效应功能
Fig4 KAT6A可维持H3K9ac和H3K27ac水平,并调节糖酵解基因的转录活性
Fig5 药物抑制KAT6A可抑制自身免疫性疾病的发展
吉满助力
本研究中所用的KAT6A sgRNA敲除质粒和Mouse_Kat6a突变表达质粒均由吉满生物提供。
了解更多质粒构建,病毒包装,稳转株构建,敲除细胞株,报告基因检测等相关服务。欢迎访问吉满生物官网:www.genomeditech.com
免费咨询电话:400-627-9288
文章来源:课题组供稿
原文引用
“The CRISPR/Cas9 system was used to delete the genomic DNA of mouse KAT6A ex vivo. sgRNAs targeting mouse KAT6A and non targeting control (mouse) sgRNA were designed (Table S4), cloned and inserted into a retro-gRNA-eGFP vector. gRNA was synthesized by Genomeditech Corp. (Shanghai, China).”
原文下载
https://www.cell.com/cell-metabolism/pdf/S1550-4131(23)00467-9.pdf