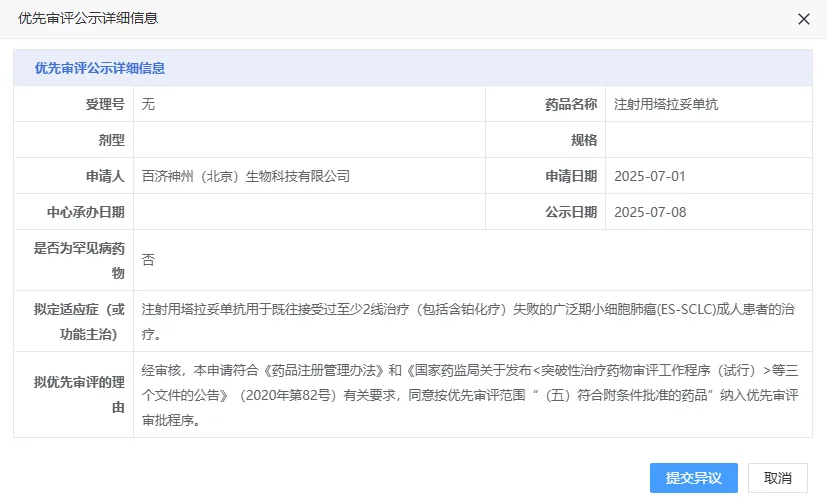
7月8日,CDE官网显示,百济神州申报的注射用塔拉妥单抗(tarlatamab)拟被纳入优先审评,用于治疗既往接受过至少二线治疗(含铂化疗)失败的广泛期小细胞肺癌(ES-SCLC)成人患者。点击了解相关产品
图源:CDE 官网
塔拉妥单抗是一款由安进公司(Amgen)研发的DLL3/CD3双特异性T细胞激活抗体(BiTE),可同时靶向肿瘤细胞表达的DLL3与T细胞上的CD3,重塑T细胞杀伤功能,精准清除DLL3阳性肿瘤细胞。2019年10月,安进与百济神州达成战略合作,联合推进该产品在中国的开发和商业化。
2025年5月,百济神州宣布,其与安进在中国联合开展的DeLLphi-307 II期研究取得积极结果。该研究专注于含铂治疗失败后的ES-SCLC患者,初步数据显示,塔拉妥单抗在疗效、安全性和耐受性方面表现良好,客观缓解率(ORR)为主要研究终点,详细数据将在即将召开的国际医学会议上披露。
此次优审申报的推进,背后还离不开全球三项关键研究数据的支持:
DeLLphi-301(FDA加速批准基础):ORR达40%,中位缓解持续时间(DoR)达9.7个月,中位总生存期(OS)14.3个月。该研究促使FDA于2024年加速批准塔拉妥单抗用于含铂化疗失败的SCLC成人患者。
DeLLphi-304(III期):中期分析显示在二线治疗中,塔拉妥单抗在总生存期上显著优于标准化疗,具有统计学和临床意义,且安全性可控。
DeLLphi-307(中国注册研究):为国内注册奠定了本土循证基础。
塔拉妥单抗的临床成果展现出在SCLC二线及以上治疗中的潜力,有望打破既往缺乏靶向免疫选择的治疗困局。随着其在中国进入优先审评通道,这一全球创新免疫疗法有望尽快惠及更多中国小细胞肺癌患者,成为二线及后线治疗的重要新选择。