12月4日,Merus宣布FDA加速批准其HER2/HER3双抗Zenocutuzumab上市,用于治疗神经调节蛋白 1 融合 (NRG1+) 非小细胞肺癌 (NSCLC) 和 NRG1+ 胰腺导管腺癌 (PDAC) 患者,商品名为Bizengri。点击此处了解HER2相关产品
Zenocutuzumab 不仅是全球首个获批的 HER2×HER3 双抗,也是FDA 批准的首个专门针对 NRG1+ 晚期不可切除或转移性 PDAC 和 NSCLC 的疗法。
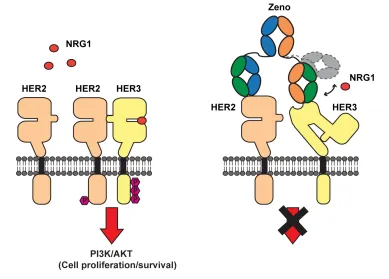
Zenocutuzumab是一种双特异性抗体,可与细胞表面表达的HER2和HER3的胞外结构域(包括肿瘤细胞)结合,抑制HER2:HER3二聚化并阻止NRG1与HER3结合。Bizengri通过阻断PI3K-AKT-mTOR信号通路的信号传导降低肿瘤细胞增殖。此外,Bizengri介导抗体依赖性细胞毒性作用。
图源:Merus 公司官网
此次获批基于eNRGy研究,该研究是一项多中心、开放标签临床研究,招募了晚期不可切除或转移性NRG1+胰腺癌或NRG1+NSCLC 患者,并且患者在既往全身治疗期间或之后出现疾病进展。
在 NRG1+ PDAC患者 (n=30) 中,ORR 为 40%, DOR 范围为 3.7 个月至 16.6 个月。
在 NRG1+ NSCLC 患者 (n=64) 中, ORR 为 33%,中位 DOR 为 7.4 个月。
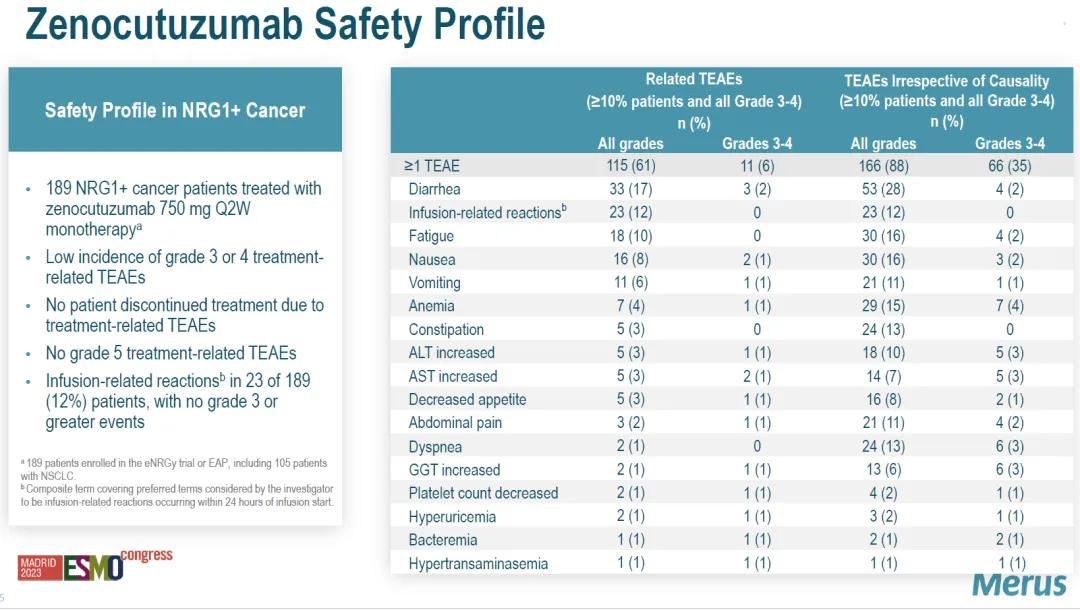
安全性数据如下。