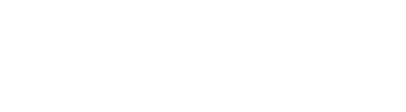实验干货
心脏疾病,如心力衰竭、心肌梗死及遗传性心肌病,是全球范围内发病率和死亡率极高的重大健康难题,传统的药物或介入治疗多局限于症状缓解,难以根治其分子病因。
AAV载体能够将目的基因稳定递送至心肌细胞,实现长期且特异的基因表达,为精准调控心脏功能、修复心肌损伤提供了崭新的技术路径。
近年来,AAV介导的基因编辑、转基因表达及RNA干扰等策略已在多个研究模型中取得鼓舞人心的进展,有望为难治性心脏疾病的基因治疗和个体化医学提供有效的新方案[1]。
心脏血清型选型
AAV血清型多种多样,不同血清型因衣壳蛋白结构差异,对心脏组织的转导效率也存在显著差异。
在这些血清型中,AAV1、AAV6、AAV8、AAV9、AAVrh10和AAVrh74被证明在不同的环境中具有心脏趋向性,其中AAV6和AAV9是应用最广泛的,尤其是AAV9,是目前公认的高效特异性靶向心脏表达的血清型,不仅可以稳定高效地表达目的基因,扩散性和感染效率也优于其他血清型。[4][5]
此外,Anc80L65是一种合成的AAV载体,与AAV9相比,它可以有效地实现心脏基因转移,并在心肌给药后实现更稳定的表达[6]。
看实验类型
AAV载体在体外和体内条件下表现出不同的细胞嗜性[7]。
体内:与包括AAV1在内的其他血清型相比,AAV9的体内基因递送可以在心肌细胞中提供更高的转基因表达;
体外:AAV6的转导效率高于AAV1和AAV9。
看注射方式
AAV2衣壳的有限效率使得直接心肌内注射成为必要;
AAV6和AAV9衣壳的高效率和天然向心性则支持全身给药[8]。
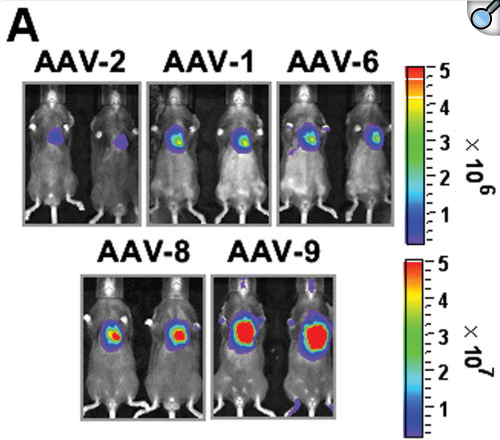
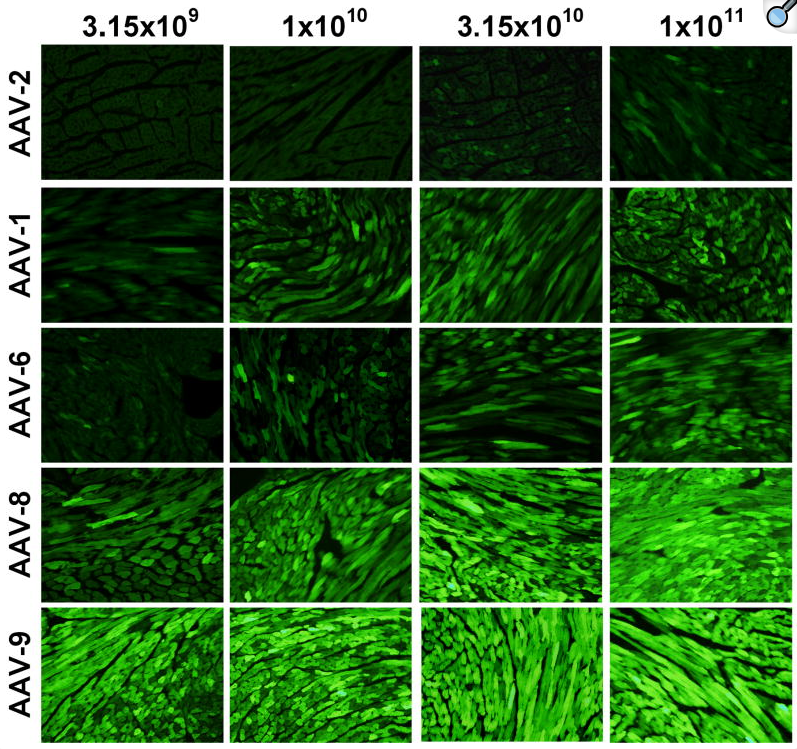
在颈静脉注射配合心肌细胞特异性启动子cTnT感染小鼠时,AAV9表现出最佳的感染效果(图1和图2)[9]。
图1 五种AAV血清型对心脏感染效率检测(感染28天后)
图2 不同病毒感染量下五种血清型对小鼠心脏的感染效果
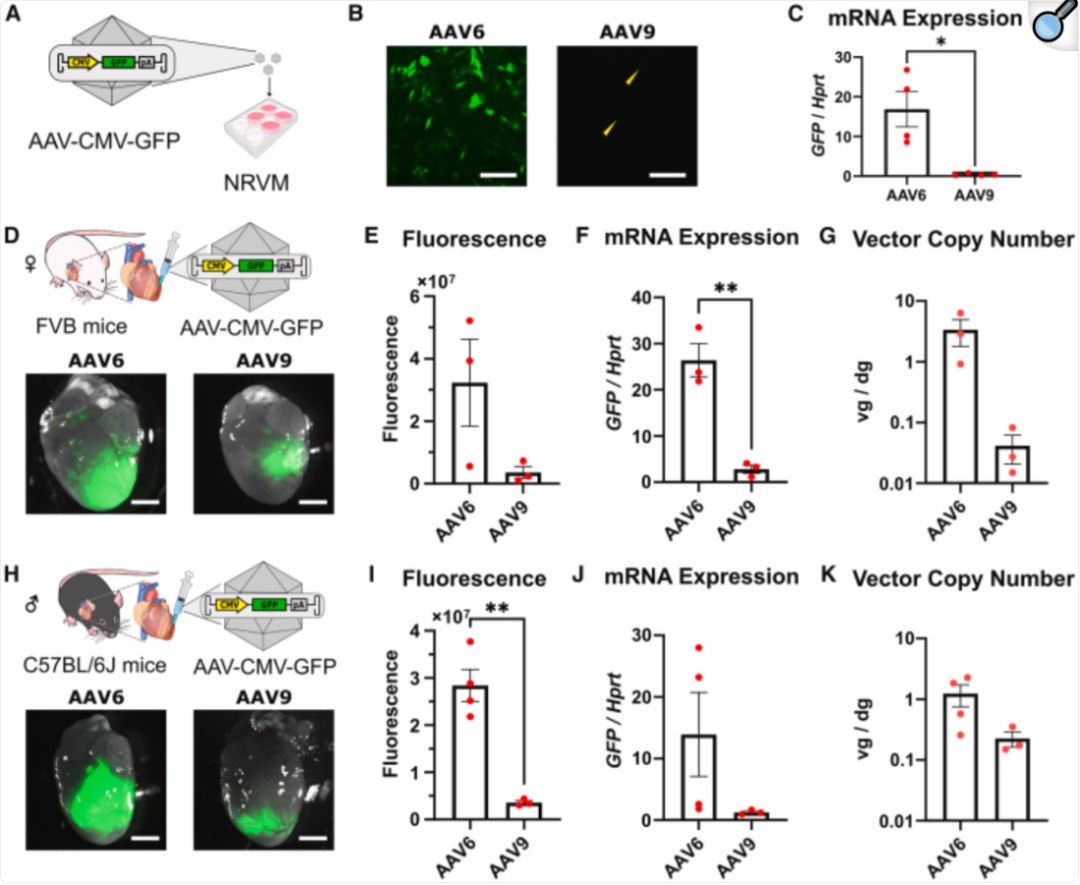
当使用心肌内注射时,AAV6介导的基因转导效率则优于AAV9(图3)[10]。
图3 使用心肌内注射时,AAV6介导的基因转导效率则优于AAV9
事实上,合理选择心脏特异性的启动子和注射方式是一种进阶策略,有助于使用基于AAV的疗法进行靶向心脏的基因递送。
关于启动子的选择
心脏由心肌细胞和非心肌细胞组成,其中心肌细胞是最普遍的心脏细胞,而心肌成纤维细胞(cardiac fibroblasts,CFs)则是最主要的非心肌细胞[11][12]。
使用细胞特异性启动子可实现对目标细胞的精准调控,避免脱靶表达。目前开发的心脏靶向AAV启动子如下:
表1 靶向心脏启动子[8][13][14][15][16][17]
关于心脏注射方式
AAV在心脏的注射方式有多种,心肌原位注射、冠状动脉注射、心包内注射、颈静脉注射和尾静脉注射均可以将药物递送到心脏,通常文献报道较多的是心肌原位多点注射和尾静脉注射。
吉满服务
对于心脏基因功能研究,吉满生物提供全面且灵活的AAV服务,可精准匹配客户的研究需求。
丰富的血清型与启动子库:吉满生物可提供包括AAV1、AAV6、AAV8、AAV9、AAV-DJ等对心脏有良好亲嗜性的血清型。同时,拥有强大的启动子库,提供高效广谱的CMV、CAG到精准靶向心脏的cTnT、αMHC、TNNT2、TCF21启动子,助您实现基因特异性表达。
先进的Cre-Loxp系统:吉满生物提供基于Cre-Loxp系统的AAV现货产品和定制服务,您无需耗费大量时间与成本繁育转基因小鼠,通过将特定的基因修饰的Cre AAV病毒注射到小鼠体内,即可高效实现心脏细胞类型特异性的基因操作,大大缩短实验周期。
客户案例
吉满生物的AAV产品凭借其稳定可靠的效果,已助力众多科研团队在心脏疾病研究领域取得突破性进展,下面展示部分客户应用案例:
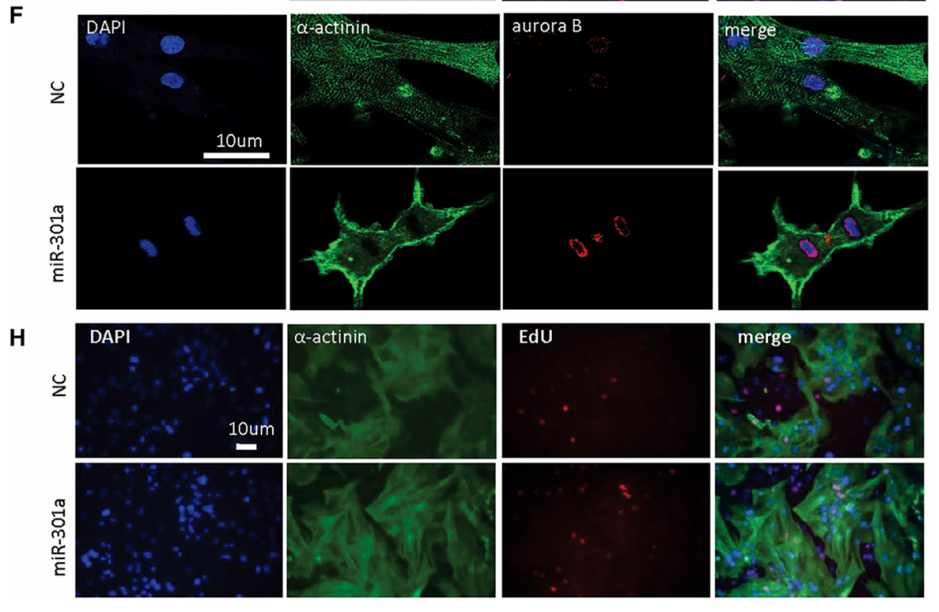
案例一:miR-301a-PTEN-AKT Signaling Induces Cardiomyocyte Proliferation and Promotes Cardiac Repair Post-MI[18]
研究背景
心肌梗死是导致全球范围内高患病率和死亡率的主要心血管疾病。当心脏因冠状动脉阻塞而发生梗死时,会导致大量心肌细胞坏死,这是心梗后心脏衰竭的主要原因。传统的心脏疾病治疗方法对心肌细胞的再生作用非常有限,并且由于成熟心肌细胞的增殖能力有限,受损的心肌很难得到充分的再生和修复。因此,如何通过促进内源性心肌细胞增殖来促进心脏损伤后修复,成为了心脏再生领域的关键科学问题。
研究结论
该研究通过系列实验,明确了miR-301a是通过靶向抑制PTEN,进而激活AKT通路来促进心肌细胞增殖的关键分子,这为开发针对心肌梗死后心脏修复的新疗法提供了重要的理论依据和潜在的靶点,也指示了通过调控miRNA(如miR-301a)来影响PTEN-AKT信号通路,从而促进内源性心肌细胞的增殖,是除传统药物和手术外治疗心脏病的一种新的潜在策略,即通过促进心肌自我修复来改善心功能。
实验细节
实验动物:8周龄的成年小鼠
血清型:AAV9
注射方式:尾静脉注射,5 × 10^11vg
注射体积:100 µL
造模:心脏损伤是通过使用丝线缝合进行冠状动脉结扎或假手术在8周龄的成年小鼠中产生的。在手术后第3天,对每只心脏受损的小鼠进行了超声心动图检查,随后通过尾静脉注射AAV。
检测时间:对于接受AAV9-miR-301a治疗的心肌梗死小鼠,在手术前的第0天、miRNA注射前的第3天、miRNA注射后的第15天以及动物处死前的第30天进行了超声心动图检查。
AAV9-miR-301a靶向小鼠原代心肌细胞并促进其增殖
吉满助力:siRNA合成、过表达AAV(AAV9-miR-301a和AAV9-miR-scramble)
案例二:Mitochondrial Amount Determines Doxorubicin-Induced Cardiotoxicity in Cardiomyocytes[19]
研究背景
阿霉素(Doxorubicin)是一种非常有效的蒽环类化疗药物,广泛应用于多种恶性肿瘤的治疗。然而,其严重的、剂量依赖性的心脏毒性是临床应用的主要限制,也是癌症幸存者后期出现心血管并发症的重要原因。传统观点认为,阿霉素的心脏毒性主要由氧化应激和直接损伤细胞DNA所驱动。但其中的详细机制,特别是为何不同个体对心脏毒性的敏感性存在差异,尚未完全阐明,这使得有效的预防和治疗策略面临挑战。
研究结论
研究团队创新性地构建了具有不同线粒体含量的心肌细胞模型,发现线粒体数量是决定细胞对阿霉素毒性敏感性的关键因素。该研究突破了传统氧化应激的认识框架,首次系统揭示了 “mtDNA泄漏-cGAS-STING通路激活”这一免疫炎症相关的新机制在阿霉素心脏毒性中的核心作用,不仅提出了线粒体移植、靶向cGAS-STING通路等新的潜在治疗方向,还发现了线粒体拷贝数这一可能的预测生物标志物,为实现个体化的心脏保护提供了新思路。
实验细节
实验动物:雄性C57BL/6小鼠(6-8周龄;体重18-22克)
血清型:AAV9
启动子:cTnT
注射方式:尾静脉注射,1 × 10^11vg
注射体积:100 µL
造模:在阿霉素诱导(心肌损伤如心力衰竭)前两周,老鼠接受了1E11 vg的单次静脉注射,注射的是携带心脏肌钙蛋白T(cTnT)启动子驱动的线粒体去氧核糖核酸酶1 cDNA的腺相关病毒9型(AAV9)病毒(AAV9-mito-DNase1)。
MIF通过CD74诱导ASMC自噬
吉满助力:过表达AAV(AAV9-mito-DNase1)
吉满生物专注提供病毒包装服务14年,在AAV包装项目有着丰富的经验。我们遵循ISO9001认证的质量体系和严格的病毒纯化工艺,确保从质粒构建到病毒包装纯化的每一步都具备高标准的质量控制。我们不仅提供包括过表达、RNA干扰(shRNA)、Cre-Loxp系统等多种功能在内的AAV定制服务,还有超多AAV现货产品,覆盖从基础功能研究到复杂疾病模型构建的广泛需求。
未来,吉满生物将继续筛选并开发AAV血清型和启动子,赋能更多的科研工作者,助力创新成果的落地。如果您有高效精准靶向心脏基因递送的需求,欢迎咨询我们!
吉满生物14周年庆
恰逢吉满生物14周年庆典,我们诚意推出明星产品特惠活动——质粒构建、病毒包装、细胞株构建三大核心产品全线优惠,统统都降至冰点价。
如果您对我们的产品和技术服务有任何需求,欢迎随时联系,我们将竭诚为您服务。

参考资料:
[1] Henry T D, Chung E S, Alvisi M, et al. Cardiotropic AAV Gene Therapy for Heart Failure: A Phase 1 Trial. Nature Medicine, 2025, Online ahead of print. DOI: 10.1038/s41591-025-04011-z.
[2] Wang S, Li Y, Xu Y, et al. AAV Gene Therapy Prevents and Reverses Heart Failure in a Murine Knockout Model of Barth Syndrome. Circulation Research, 2020, 126(08): 1024-1039. DOI: 10.1161/CIRCRESAHA.119.315956.
[3] 廖敏琪, 郭素峡. 腺相关病毒的基因疗法在心血管疾病中的应用. 生命科学, 2021, 33(03): 392-399.
[4] Zhang H, Zhan Q, Huang B, et al. AAV-Mediated Gene Therapy: Advancing Cardiovascular Disease Treatment. Frontiers in Cardiovascular Medicine, 2022, 9: 952755. DOI: 10.3389/fcvm.2022.952755.
[5] Mason D, Chen Y Z, Krishnan H V, et al. Cardiac Gene Therapy: Recent Advances and Future Directions. Journal of Controlled Release, 2015, 215: 101-111. DOI: 10.1016/j.jconrel.2015.08.001.
[6] Katz M G, Hadas Y, Bailey R A, et al. Efficient Cardiac Gene Transfer and Early-Onset Expression of a Synthetic Adeno-Associated Viral Vector, Anc80L65, after Intramyocardial Administration. Journal of Thoracic And Cardiovascular Surgery, 2022, 164(06): e429-e443. DOI: 10.1016/j.jtcvs.2021.05.050.
[7] Ambrosi C M, Sadananda G, Han J L, et al. Adeno-Associated Virus Mediated Gene Delivery: Implications for Scalable in Vitro and in Vivo Cardiac Optogenetic Models. Frontiers in Physiology. 2019, 100: 168. DOI: 10.3389/fphys.2019.00168.
[8] Nakano K, Sadahiro T, Fujita R, et al. Development of Adeno-Associated Viral Vectors Targeting Cardiac Fibroblasts for Efficient in Vivo Cardiac Reprogramming. Stem Cell Reports, 2024, 19(10): 1389-1398. DOI: 10.1016/j.stemcr.2024.08.002.
[9] Prasad K M, Xu Y, Yang Z, et al. Robust Cardiomyocyte-Specific Gene Expression Following Systemic Injection of AAV: in Vivo Gene Delivery Follows a Poisson Distribution. Gene Therapy. 2011, 18(01): 43-52. DOI: 10.1038/gt.2010.105.
[10] Wang J, Jonker T, Cervera-Barea A, et al. AAV6 Vectors Provide Superior Gene Transfer Compared to AAV9 Vectors Following Intramyocardial Administration. Molecular Therapy-methods & Clinical Development. 2025, 33(03):101532. DOI: 10.1016/j.omtm.2025.101532.
[11] 曹策, 姚明江, 刘建勋. 心肌成纤维细胞对心肌损伤后的修复和再生作用及中药调节. 中国药理学通报, 2023, 39(08): 1411-1416.
[12] Litviňuková M, Talavera-López C, Maatz H, et al. Cells of the Adult Human Heart. Nature, 2020, 588(7838): 466-472. DOI: 10.1038/s41586-020-2797-4.
[13] Grisorio L, Bongianino R, Gianeselli M, et al. Gene Therapy for Cardiac Diseases: Methods, Challenges, and Future Directions. Cardiovascular Research, 2024, 120(14): 1664-1682. DOI: 10.1093/cvr/cvae207.
[14] Ravindran D, Rao R, Mundisugih J, et al. High-Throughput Evaluation of Cardiac-Specific Promoters for Adeno-Associated Virus Mediated Cardiac Gene Therapy. Gene Therapy. 2025, Online ahead of print. DOI: 10.1038/s41434-025-00553-6.
[15] Ni L, Scott L Jr, Campbell H M, et al. Atrial-Specific Gene Delivery Using an Adeno-Associated Viral Vector. Circulation Research, 2019, 124(02): 256-262. DOI: 10.1161/CIRCRESAHA.118.313811.
[16] Francisco J, Zhang Y, Nakada Y, et al. AAV-Mediated YAP Expression in Cardiac Fibroblasts Promotes Inflammation and Increases Fibrosis. Scientific Reports, 2021, 11(01): 10553. DOI: 10.1038/s41598-021-89989-5.
[17] Mao A, He D, Zhang K, et al. Functional Role of Coupling the Endothelial TRPV4 and KCa 3.1 Channels in Regulating Coronary Vascular Tone. British Journal of Pharmacology. 2023, 180(17): 2266-2279. DOI: 10.1111/bph.16082.
[18] Zhen L, Zhao Q, Lü J, et al. MiR-301a-PTEN-AKT Signaling Induces Cardiomyocyte Proliferation and Promotes Cardiac Repair Post-MI. Molecular Therapy-nucleic Acids. 2020, 22: 251-262. DOI: 10.1016/j.omtn.2020.08.033.
[19] Xiong W, Li B, Pan J, et al. Mitochondrial Amount Determines Doxorubicin-Induced Cardiotoxicity in Cardiomyocytes. Advanced Science. 2025, 12(12):e2412017. DOI: 10.1002/advs.202412017.