实验干货
上文我们提到腺相关病毒(AAV)作为一种高效的基因递送工具,因其非致病性、低免疫原性、表达长效性和广泛的靶向性而受到广泛关注。AAV载体:基因精准递送的“特快专员”
然而,AAV有多种血清型(Serotypes),不同血清型对细胞或组织的感染效率大相径庭。如何选择合适的血清型,成为实验成功的关键因素之一。本文将为您全面解析AAV血清型的选择策略。
背景简介
AAV血清型源于其基因组中衣壳蛋白编码区(cap)的差异,Cap基因序列不同,导致衣壳蛋白的氨基酸序列和三维空间结构存在差异,由此产生不同的血清型。
每种血清型的衣壳蛋白只能与特定细胞表面的糖类或受体结合(如硫酸肝素蛋白聚糖、半乳糖等),这种初始结合以及随后与二级膜蛋白受体的相互作用,共同赋予了AAV不同的组织趋向性、转导效率、抗原性以及穿透细胞障碍的能力[1]。
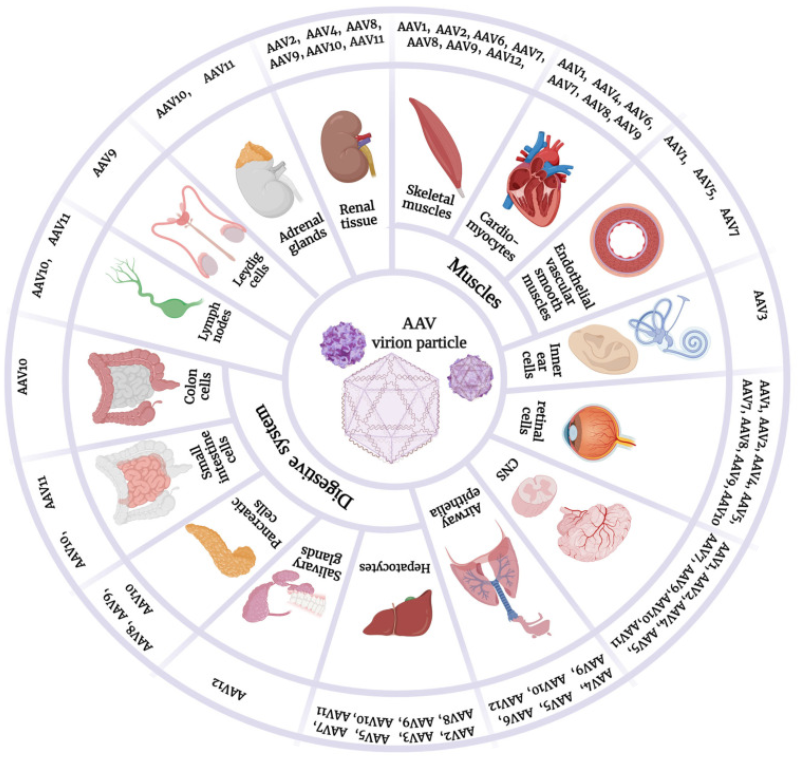
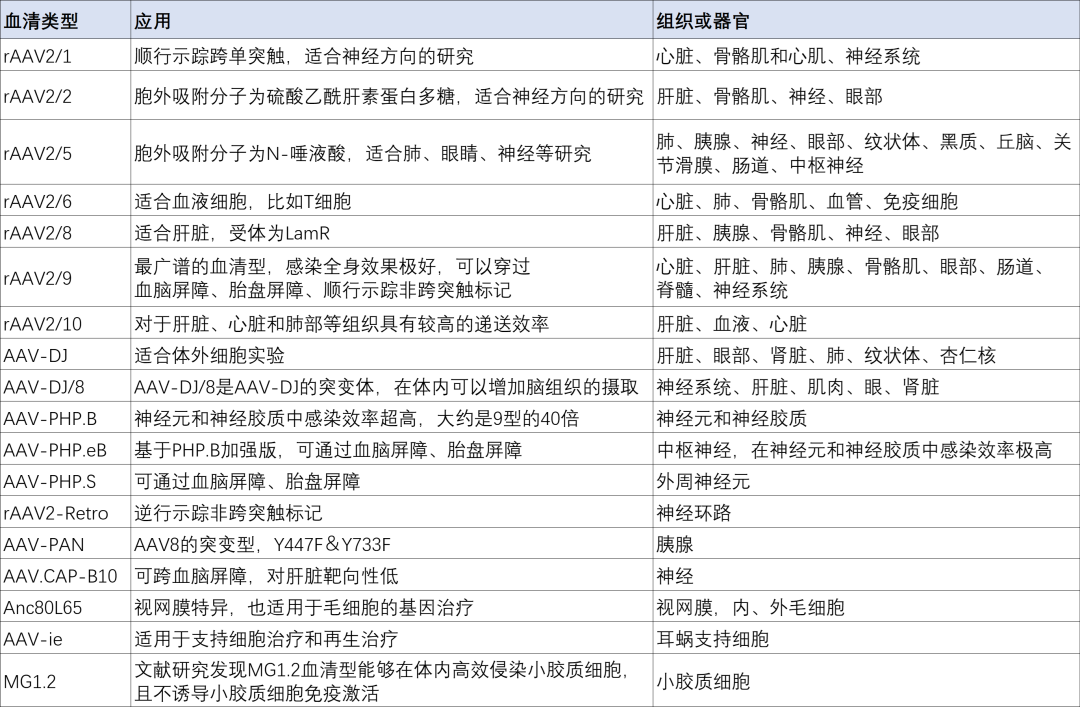
常见AAV血清型
常见的血清型靶向[3]
截至目前,已经发现并分类了多种AAV血清型,它们在肝脏、心脏、骨骼肌、眼睛和中枢神经系统等组织中有不同的转导效率。下表列出目前常见的AAV血清型,其中科研中最常用的是1、2、5、8、9型。
上标注解
h:人 c:犬 i:猪 m:小鼠 p:非人灵长类动物 r:老鼠 s:羊
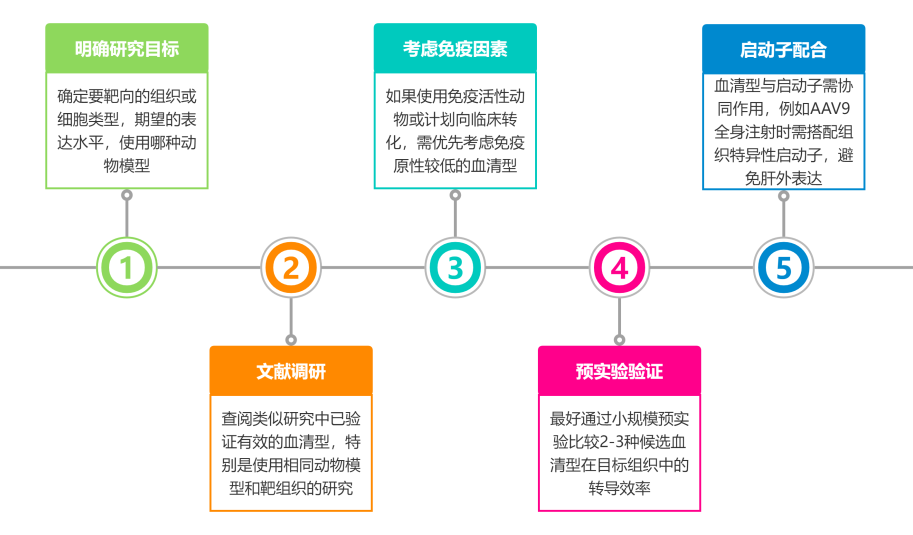
关于血清型的选择
关键因素
一、实验目的
若需广泛表达,可选择AAV8、AAV9等全身穿透性血清型;
若需在全脑范围内表达基因,可选择AAV9、AAV-PHP.eB、AAV.CAP-B10等可以跨越血脑屏障的血清型;
若需精细调控,则选择合适的血清型。
二、靶组织或器官
不同的AAV血清型对不同的组织和细胞类型有天然的亲和性。根据目标组织选择匹配的血清型是实验成功的关键。
神经系统:全身注射优先选择AAV9或AAV-PHP.eB;局部注射则AAV2或AAV5在神经元中表达更精准,适合特定脑区研究。
肝脏:AAV8和AAV9对肝细胞有高度亲和性,适合全身注射靶向肝细胞。AAV6可感染肝星状细胞等非实质细胞,需配合特异性启动子。
肌肉:AAV1和AAV7对骨骼肌和心肌穿透力强,适合局部注射治疗肌肉疾病。AAV9全身注射也可有效转导肌肉细胞。
肺部:AAV6对呼吸道和肺泡II型细胞感染效率高,适用于肺部疾病基因治疗。高等灵长类动物中,AAV1对肺部感染效率更高。
视网膜:AAV2或AAV2.7m8通过玻璃体腔注射,可高效感染视网膜细胞。
内耳:在新生小鼠中AAV1和变体Anc80L65、AAV2.7m8、AAV9-PHP.B等显示高效转导毛细胞能力;而在成年小鼠中,AAV2和Anc80L65表现较好
三、动物模型 不同动物模型对同一AAV血清型的反应可能存在差异,因此在选择血清型时需考虑实验所使用的物种。 小鼠:AAV8和AAV9在小鼠模型中常被使用,尤其是靶向肝脏和心脏时。值得注意的是,一些新型工程化血清型如AAV-PHP.B在小鼠中表现出优异的血脑屏障穿透能力,但在非人灵长类动物中效果可能不如AAV9。 大鼠:AAV2、AAV5和AAV9在大鼠中表现良好 非人灵长类动物(NHP):AAV7、AAV8、AAV9和AAVrh10通常在NHP中效果较好。近期研究表明,一些如AAV.CPP.16的血清型在NHP中的转导效率优于AAV9。
参考步骤 在实际研究中,血清型选择可遵循以下步骤: 建议根据具体实验需求,结合文献报道或进行预实验,选择最适合的AAV血清型和启动子组合。
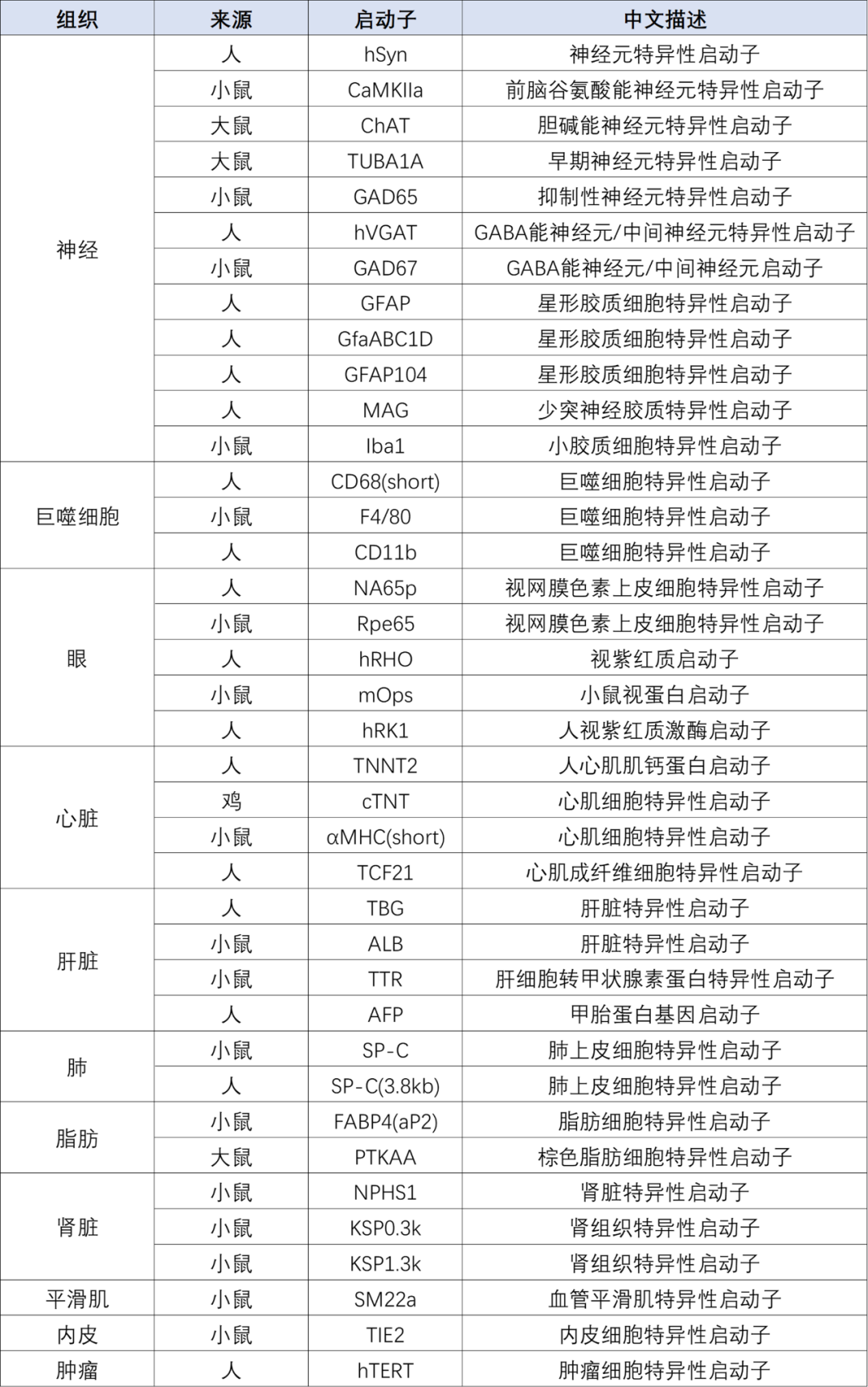
吉满服务 依托先进的技术创新实力、丰富的现货载体以及专业的定制服务,吉满生物为客户提供了丰富的AAV血清型选择,旨在满足针对不同组织器官和特定细胞类型的研究需求。 不同AAV血清型介绍
血清型主要决定组织/细胞层面的趋向性,而启动子则决定基因表达在细胞类型层面的特异性,两者协同才能实现精准靶向。 吉满生物还可以提供神经、眼睛、骨骼肌、肝脏、血管、脂肪、胰腺、肾脏等不同组织的特异性启动子来驱动特定细胞或组织中的基因表达,同时也可以开发针对特定基因编辑的高效AAV载体,充分满足客户实验需求。 现有组织特异启动子,更多组织特异性启动子持续开发中!
吉满生物专注提供病毒包装服务14年,在AAV包装项目有着丰富的经验。我们遵循ISO9001认证的质量体系和严格的病毒纯化工艺,AAV包装交付速度快、纯度高、滴度高、血清型丰富。此外我们还有完善的客户服务体系,包括技术支持、项目跟进和售后服务,提供全程管家式服务,确保您订购无忧!
吉满生物14周年庆 恰逢吉满生物14周年庆典,我们诚意推出明星产品特惠活动:质粒构建、病毒包装、细胞株构建三大核心产品全线优惠,统统都降至冰点价。如果您对我们的产品和技术服务有任何需求,欢迎随时联系,我们将竭诚为您服务。 立即联系
扫码咨询 快速响应
参考文献: [1] Pupo A, Fernández A, Low S H, et al. AAV vectors: The Rubik's Cube of Human Gene Therapy. Molecular Therapy. 2022, 30(12): 3515-3541. [2] Costa Verdera H, Kuranda K and Mingozzi F. AAV Vector Immunogenicity in Humans: A Long Journey to Successful Gene Transfer. Molecular Therapy. 2020, 28(03): 723-746. [3] Issa S S, Shaimardanova A A, Solovyeva V V, et al. Various AAV Serotypes and Their Applications in Gene Therapy: An Overview. Cells. 2023, 12(05): 785. [4] Wang D, Tai P W L and Gao G. Adeno-associated Virus Vector as a Platform for Gene Therapy Delivery. Nature Reviews Drug Discovery. 2019, 18(05): 358-378.
DOI: 10.1016/j.ymthe.2022.09.015.
DOI: 10.1016/j.ymthe.2019.12.010.
DOI: 10.3390/cells12050785.
DOI: 10.1038/s41573-019-0012-9.