2025年5月15日,美国FDA批准Incyte公司开发的PD-1单抗retifanlimab-dlwr(Zynyz® ),联合卡铂和紫杉醇用于治疗无法手术的局部复发或转移性肛管鳞状细胞癌(SCAC)成人患者的一线治疗。同时,该药也获批作为单药,用于既往接受含铂化疗后进展或无法耐受治疗的局部复发或转移性SCAC患者。
Zynyz 补充生物制品许可申请 (sBLA) 的优先审查和 FDA 批准基于两项试验的数据:
第 3 阶段 POD1UM-303/InterAACT2 试验:评估 Zynyz 联合铂类化疗(卡铂-紫杉醇)治疗先前未接受过全身化疗的转移性或无法手术的局部复发性 SCAC 成年患者;
第 2 阶段 POD1UM-202 试验:评估 Zynyz 单药治疗先前接受过治疗的局部晚期或转移性 SCAC 患者,这些患者在铂类化疗后病情进展或不耐受。
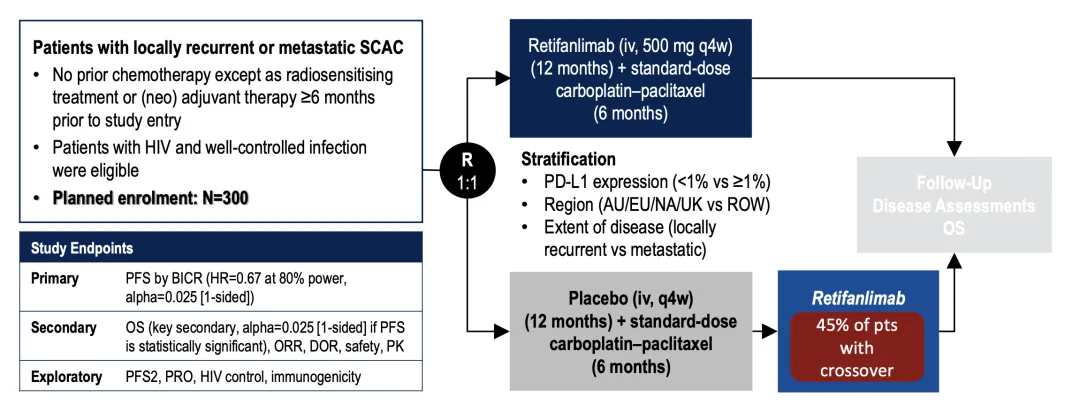
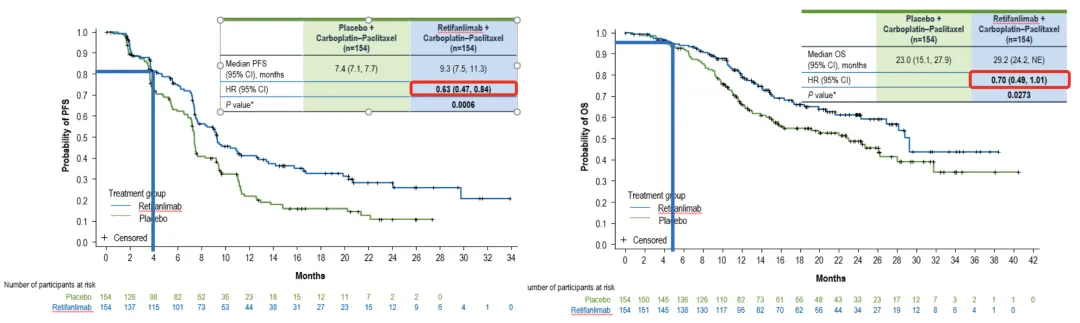
POD1UM-303/InterAACT 2研究(NCT04472429),该项随机、多中心、双盲III期试验共纳入308例未接受化疗的晚期SCAC患者,所有患者均接受标准的卡铂+紫杉醇方案,并随机分配接受retifanlimab-dlwr或安慰剂。主要终点为独立影像评估的无进展生存期(PFS),次要终点包括总生存期(OS)、客观缓解率(ORR)及缓解持续时间(DOR)。结果显示,retifanlimab组的中位PFS为9.3个月,显著优于对照组的7.4个月(HR=0.63,p=0.0006)。此外,中期分析还观察到中位总生存期(OS)提高了6.2个月(P=0.0273);OS随访仍在进行中。未观察到新的安全性信号。47%接受Zynyz联合化疗的患者出现了严重不良反应。最常见的严重不良反应(≥2%的患者)是败血症(3.2%)、肺栓塞(3.2%)、腹泻(2.6%)和呕吐(2.6%)。
在单药治疗方面,POD1UM-202研究(NCT03597295)评估了94例含铂治疗失败的SCAC患者使用retifanlimab-dlwr的疗效。该试验为单臂、多中心、开放标签设计,结果显示ORR为14%,疾病控制率为49%。中位缓解持续时间为9.5个月,提示部分患者可从单药中获得长期临床获益。
Retifanlimab是一款人源化IgG4亚型PD-1抗体,最初由MacroGenics研发。2017年,Incyte通过签订全球独家合作许可协议获得该药物的全球权利。2019年,再鼎医药以1750万美元预付款和最高6000万美元里程碑款项从Incyte引进其大中华区权益,试图借助Zynyz布局免疫治疗市场。
Retifanlimab通过解除免疫系统的“刹车装置”,激活人体自身的免疫细胞去攻击癌细胞。这种机制对像SCAC这样与病毒相关的癌症可能特别有效,因为病毒感染会让免疫系统的杀伤力下降,而免疫治疗可以“唤醒”这些免疫细胞。这款药物每4周通过静脉注射一次,相比于其他需要更频繁注射的免疫药物,治疗过程对患者来说更方便。
Zynyz® 亦获批用于治疗转移性或复发性局部晚期的默克尔细胞癌(MCC)成人患者,该适应症基于肿瘤缓解率和缓解持续时间获得美国FDA的加速批准。其持续上市许可将取决于后续验证性临床试验对其临床获益的进一步确认与支持。
然而,这款PD-1抗体的早期发展并不顺遂。2021年,Zynyz用于治疗接受过含铂化疗或不耐受的局部晚期或转移性肛管鳞状细胞癌(SCAC)患者的BLA申请虽然获得FDA优先审评资格,却因临床试验入组样本量有限、总缓解率不高而遭到拒绝。这一挫折直接导致Incyte当时股价暴跌30%,再鼎也随即下跌12%。
2023年1月,再鼎医药宣布终止与Incyte的Zynyz合作,并在2022年财报中称“基于竞争格局的变化”,选择及时止损,完成市场撤退。虽然将继续支持已有研究的平稳过渡,但这也宣告Zynyz在中国商业化的希望暂时搁浅。
不过,命运的转折点在2025年再次到来。此次SCAC适应症的获批,标志着Incyte在肿瘤免疫治疗领域的进一步突破,也为罕见癌种患者带来了新的治疗希望。此番再度闯关成功,使Zynyz重回公众视野,也证明了其在小众适应症领域仍有不可忽视的临床价值。