2025年4月23 日,美国 FDA 宣布已批准康方生物/正大天晴的 PD-1 单抗派安普利单抗上市,联合顺铂或卡铂和吉西他滨用于复发性或转移性非角化性鼻咽癌 (NPC) 成人患者的一线治疗。点击了解PD-1相关产品
此外,FDA 还批准派安普利单抗作为单药用于治疗在铂类化疗及至少一种其他既往疗法期间或之后病情进展的转移性非角化性鼻咽癌 (NPC) 成人患者。

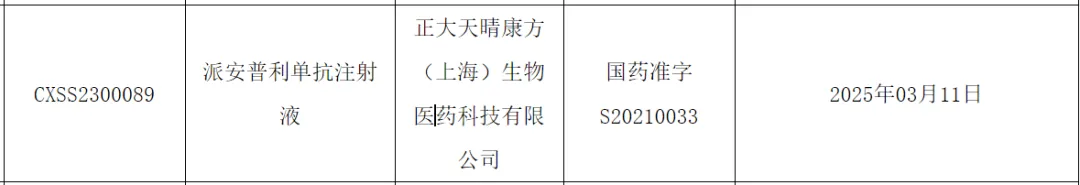
派安普利单抗由康方生物自主研发、并由康方生物与中国生物旗下正大天晴药业集团合资的正大天晴康方负责后续开发和商业化。今年3月,据中国国家药监局(NMPA)官网最新公示,派安普利单抗注射液新适应症上市申请已获得批准,获批的适应症为:联合化疗一线治疗复发或转移鼻咽癌(NPC)。
图源:NMPA官网
本次FDA获批是基于AK105-304 研究和 AK105-202 研究的数据。
AK105-304 研究 (NCT04974398) 是一项随机、双盲、多中心临床试验,纳入了 291 例复发性或转移性鼻咽癌患者,这些患者此前均未接受过针对复发性或转移性鼻咽癌的全身化疗。患者按 1:1 的比例随机分配接受以下治疗:接受派安普利单抗联合顺铂或卡铂和吉西他滨治疗,随后接受派安普利单抗治疗;或接受安慰剂治疗,即接受顺铂或卡铂和吉西他滨治疗,随后接受安慰剂治疗。
AK105-304 研究的主要疗效指标是无进展生存期 (PFS),由盲法独立审查委员会根据 RECIST v1.1 标准进行评估。总生存期 (OS) 是关键的次要终点。
数据显示,派安普利单抗组的中位 PFS 为 9.6 个月(95% CI: 7.1, 12.5),安慰剂组为 7.0 个月(95% CI: 6.9, 7.3)(风险比 [HR] 0.45 [95% CI: 0.33, 0.62],双侧 P 值 < 0.0001)。在 12 个月的随访后,派安普利单抗组和安慰剂组分别有 31% 和 11% 的患者存活且无进展。虽然 OS 结果尚不成熟,最终分析报告的死亡率为预设的 70%,但未观察到任何不利趋势。
AK105-202 研究 (NCT03866967) 是一项在单一国家开展的开放标签、多中心、单组试验,旨在评估派安普利单抗单药疗法的疗效。该试验共纳入 125 例无法切除或转移性非角化性鼻咽癌患者,这些患者在接受铂类化疗和至少一线其他疗法后病情出现进展。患者接受派安普利单抗治疗,直至病情进展或出现不可接受的毒性反应,最长疗程为 24 个月。
AK105-202 研究的主要疗效指标是客观缓解率 (ORR) 和缓解持续时间 (DOR),该指标由独立放射学审查委员会 (IRRC) 根据 RECIST v1.1 进行评估。数据显示,ORR 为 28%(95% CI:20, 37),中位 DOR 未达到(95% CI:9.2,无法估计)。
安全性方面,派安普利单抗治疗期间发生的免疫介导不良反应包括肺炎、结肠炎、肝炎、内分泌疾病、伴有肾功能障碍的肾炎以及皮肤不良反应。
派安普利单抗与顺铂或卡铂联合吉西他滨治疗时,最常见的不良反应(≥20%)为恶心、呕吐、甲状腺功能减退、便秘、食欲下降、体重下降、咳嗽、COVID-19 感染、疲劳、皮疹和发热。
派安普利单抗单药治疗时,最常见的不良反应(≥20%)为甲状腺功能减退和肌肉骨骼疼痛。1% 的患者发生了致命性不良反应,包括肺炎、感染性休克、结肠炎和肝炎各一例。
派安普利单抗与顺铂或卡铂和吉西他滨联合治疗的推荐剂量为每三周 200 毫克,直至病情进展或出现不可接受的毒性,最长疗程为 24 个月。对于既往接受过治疗的鼻咽癌,派安普利单抗单药治疗的推荐剂量为每两周 200 毫克,直至病情进展或出现不可接受的毒性,最长疗程为 24 个月。