1月16日, 信达生物宣布其抗紧密连接蛋白18.2(CLDN18.2)抗体-依喜替康偶联物(ADC)IBI343已被CDE纳入突破性治疗药物(BTD)品种名单,拟定适应症为至少接受过一种系统性治疗的CLDN18.2表达阳性的晚期胰腺导管腺癌。点击了解CLDN18.2产品详情
本次突破性治疗药物认定是基于一项正在中国、澳洲和美国进行的I期临床研究结果(NCT05458219),IBI343单药在晚期胰腺导管腺癌患者中显示了令人鼓舞的疗效和良好的耐受性。该I期扩展队列的数据在2024年欧洲肿瘤内科学会亚洲年会(ESMO Asia)大会上口头形式报道:
共43例CLDN18.2阳性(定义为≥60%肿瘤细胞中CLDN18.2染色强度≥1+)晚期胰腺癌受试者接受IBI343 6 mg/kg Q3W治疗,所有受试者既往均接受至少1线治疗,60.5%的受试者既往接受过2线及以上的抗肿瘤治疗。
确认的客观缓解率(ORR)为 23.3%,截至数据截止日期,26例受试者发生PFS事件,中位PFS为5.3 (4.1-7.4)月。
2024年5月,IBI343首个适应症获CDE纳入突破性治疗药物,为至少接受过二种系统性治疗的CLDN18.2表达阳性的晚期胃/胃食管交界处腺癌。
2024年6月,IBI343获得美国FDA授予快速通道资格(fast track designation, FTD),拟定适应症为至少接受过一种系统性治疗的CLDN18.2表达阳性的晚期胰腺导管腺癌。目前,IBI343已启动美国临床I期入组并于2024年12月完成首例受试者给药。
胰腺癌是消化系统恶性程度最高的肿瘤之一,5年生存率约10%。近年来,胰腺癌发病率逐年升高,但早期诊断率极低,严重危害人类生命健康。
目前,晚期胰腺癌治疗仍以系统性化疗为基础,一线治疗方案多采用以氟尿嘧啶(5-FU)或吉西他滨为基础的化疗方案。而在二线治疗中,临床选择十分有限,化疗响应率仅为6-16%,中位无进展生存期约2~5个月,中位生存期大约6~9个月ii,存在亟待满足的临床需求。
胃癌和胰腺癌等肿瘤的靶向治疗手段较匮乏,存在巨大的未满足的临床需求。CLDN18.2高表达于胃癌和胰腺癌中,靶向CLDN18.2的药物是潜在的新型抗肿瘤治疗方案。
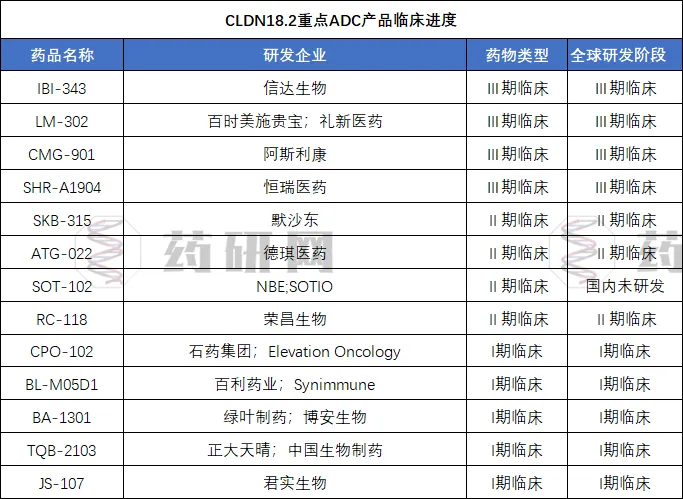
目前为止,全球20多家药企布局了claudin 18.2靶向药物的临床开发,大部分在研项目属于单靶点抗体药物,此外还包括claudin 18.2双抗药物、ADC和CAR-T等。目前CLDN18.2靶点进入临床阶段的重点CLDN18.2 ADC产品有10余款,其中进入III期临床的有信达生物IBI-343、礼新医药LM-302、阿斯利康CMG-901、恒瑞医药SHR-A1904。