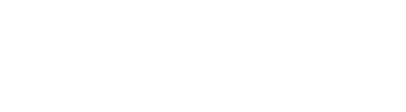文献解读
如何理解“细胞生存依赖于抗氧化剂”
谷胱甘肽(GSH)是由谷氨酸、半胱氨酸和甘氨酸组成的三肽,它在细胞内的浓度非常高,是细胞内最主要的抗氧化剂。
GSH的主要作用是清除自由基(ROS),保护细胞免受氧化应激的损害,ROS积累过多会对细胞的结构和功能造成损伤。
GSH 的合成受谷氨酸半胱氨酸连接酶催化亚基 (GCLC) 非冗余控制。GSH失衡与许多疾病有关,但成人组织对GSH的需求尚不清楚。
文献来源

2024年6月,Nature Communications 在线发表了题为"Glutathione synthesis in the mouse liver supports lipid abundance through Nrf2 repression" 的研究论文。
该研究利用GCLC条件性敲除小鼠模型以及多组学手段探究了GSH与肝脏脂质代谢之间的关联,揭示了肝脏GSH合成的核心功能是促进脂质的积累。
项目研究
研究团队将 Gclcf/f 和 Rosa26-CreERT2 这2种基因工程小鼠品系进行杂交,构建全身Gclc敲除(Gclc KO)KO模型。
Gclc 的缺失导致小鼠体重急剧下降并且存活率降低,而Gclc WT小鼠没有出现这种现象,表明GSH是维持成年小鼠存活所必需的。
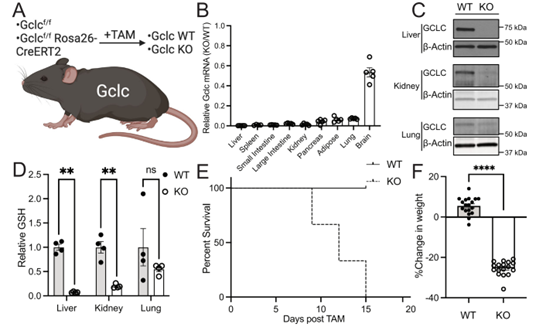
Figure.1 GSH缺失导致小鼠体重下降和存活率降低
肝脏是GSH最大的生产者之一。作者对Gclc KO小鼠的肝组织和血清生化标志物进行检验发现肝组织没有发生损伤。
经代谢组学分析发现,在GSH缺乏的情况下,肝脏蓄积GSH前体,并可将其重新定向至其他代谢途径。通过转录组学和蛋白质组学分析,发现Gclc KO小鼠肝脏中由Nrf2基因编码的蛋白质及下游靶基因表达升高。
这一结果表明在GSH耗尽时,机体有可能通过激活Nrf2来上调抗氧化途径从而减弱GSH缺失诱导的氧化应激损伤。
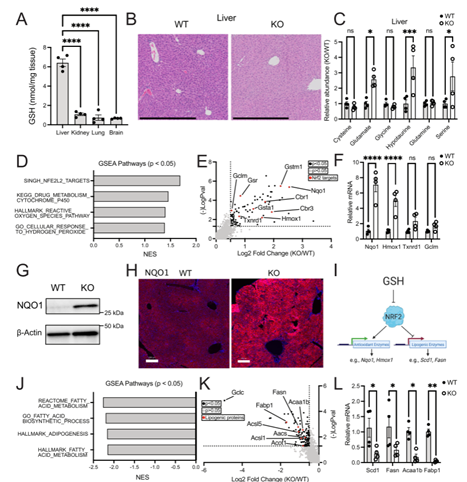
Figure2 Gclc KO小鼠诱导Nrf2靶基因表达,抑制脂肪生成基因表达
作者进一步研究GSH消耗后,脂肪生成基因表达受到抑制。与此一致,Gclc KO小鼠的甘油三酯丰富也较低。通过高脂肪饮食(HFD)可以挽救Gclc KO小鼠中低水平的甘油三酯,但体重仍然呈现下降趋势。此外,小鼠GSH合成缺乏会导致脂肪生成酶(SCD1)和相应脂质种类的表达下降。
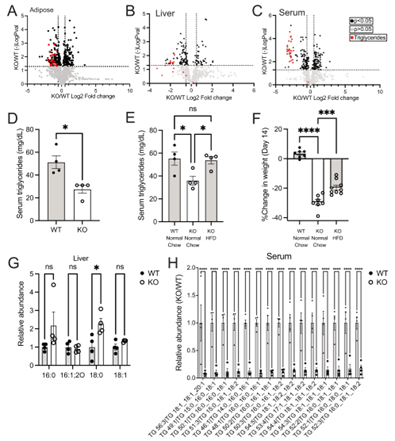
Figure3 小鼠GSH耗尽后,甘油三酯的含量降低
肝脏特异性GSH合成是否负责下调脂肪生成基因表达和降低血清甘油三酯?
作者利用AAV-TBG-Cre病毒传递系统构建Gclc肝脏特异性敲除(Gclc - L-KO)小鼠。发现Gclc - L-KO小鼠肝脏的Gclc mRNA快速消耗,Gclc蛋白和GSH水平的逐渐下降,并导致Nrf2活性增加,脂肪生成酶表达受损,循环甘油三酯降低,并且诱导的Nrf2活性升高呈现剂量依赖性。
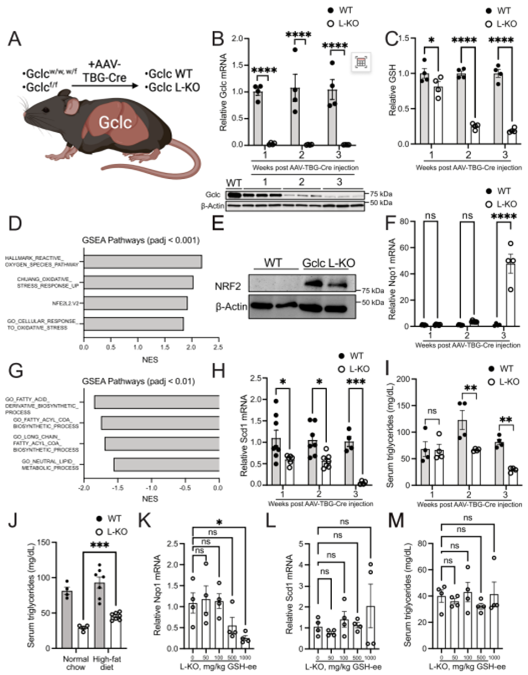
Figure4 肝脏特异性Gclc表达维持脂质合成并抑制Nrf2激活
随后,作者又构建了Gclc和Nrf2双敲除(L-DKO)模型,L-DKO小鼠的Gclc和Nrf2 mRNA水平下降,Nrf2的敲除使脂质合成减少以及肝损伤程度降低的表型被逆转。换句话说,GSH通过抑制Nrf2在肝脏中的激活来促进脂质积累。
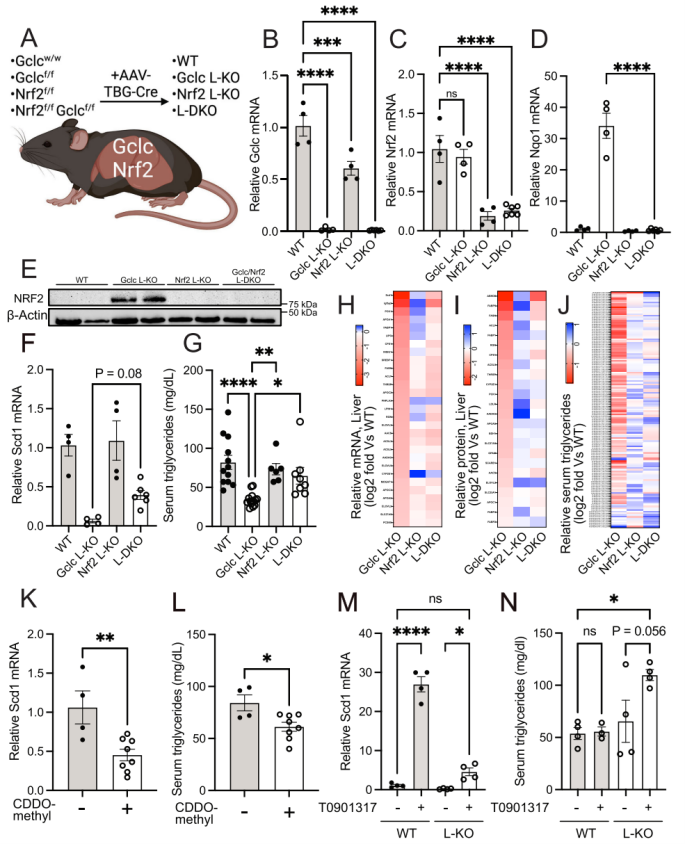
Figure5 肝脏中的GSH以Nrf2依赖的方式维持甘油三酯水平
研究结论
GSH水平在肝脏组织中最高,肝脏组织也是脂质产生的中心。虽然GSH的损失不会导致肝功能衰竭,但它会降低脂肪生成酶的表达,循环甘油三酯水平和脂肪储存。
从机制上讲,研究发现GSH通过抑制氧化应激诱导的转录因子NRF2来促进脂质丰度。这些研究确定GSH作为肝脏氧化还原缓冲和甘油三酯产生平衡的支点。
吉满生物
如想了解更多质粒构建、病毒包装、稳转株构建、敲除细胞株、报告基因检测等相关服务。欢迎访问吉满生物官网:www.genomeditech.com
免费咨询电话:400-627-9288