11月7日,南京维立志博与风险投资公司Aditum Bio宣布,基于维立志博全球首创CD19xBCMAxCD3三特异性T细胞衔接器抗体LBL-051,成立新药研发公司Oblenio Bio并达成了独家选择权及许可协议。Aditum 将为Oblenio提供资金,双方将合作迅速推进LBL-051进入临床研究。
根据协议条款,维立志博将授予Oblenio在全球范围内开发、生产和商业化LBL-051的独家选择权和许可,并有权获得3500万美元的首付款和近期付款,在达成开发、监管注册、销售里程碑事件后,维立志博还将有权获得最高达5.79亿美元的总交易额款项,以及未来产品的销售分成。此外,维立志博还将有权获得Oblenio的股权。
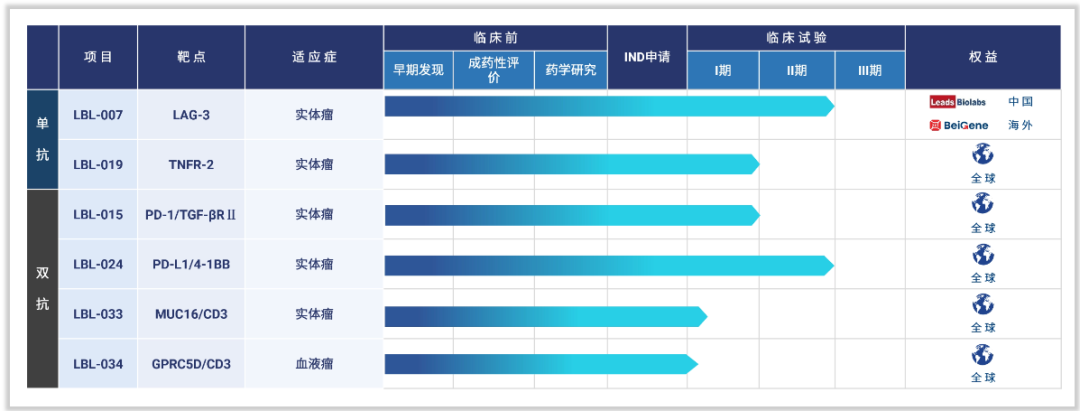
维立志博官网当前并未披露这款三抗管线(LBL-051)。据其公告,LBL-051是应用维立志博自主研发并具有知识产权的技术平台LeadsBody™开发的新型三特异性T细胞衔接器,其每个靶标CD19、BCMA、CD3的结合域均经过精心设计与优化,以实现疗效与安全性的最佳平衡。点击了解CD19/CD3相关产品。
LBL-051管线CD3/CD19/BCMA三抗数据未披露,与CD3/CD19/BCMA同出一个平台的还有CD3/GPRC5D双抗—LBL-034,以LBL-034管线为例:
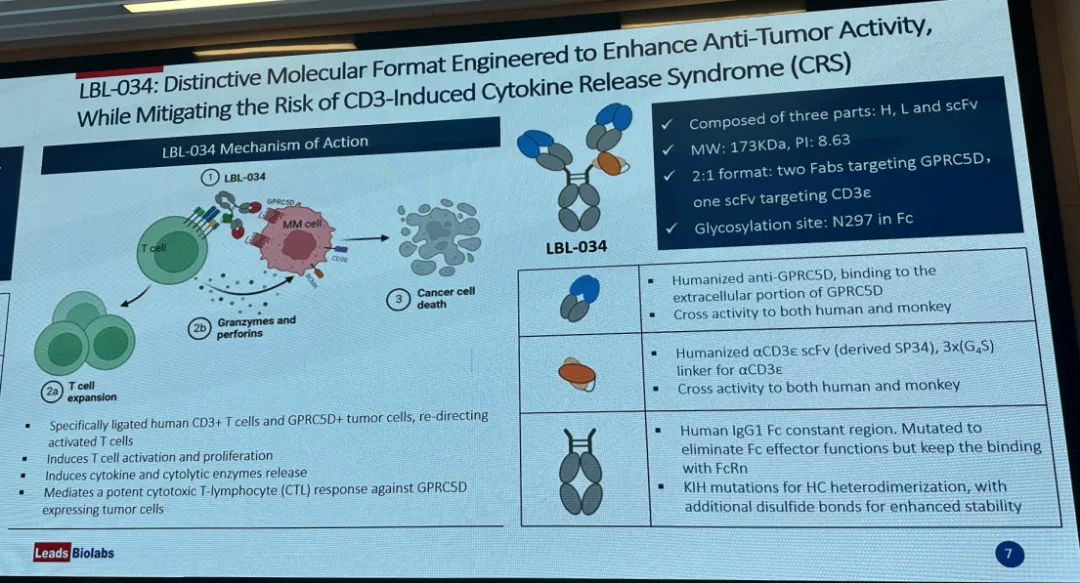
作为一款CD3/GPRC5D双抗,采用的2:1的结构,去除了Fc的效应功能,CD3抗体以scFv的形式放置于Fab之下。目前CD3/GPRC5D双抗展现了极为优异的临床数据及安全性。展现了极为优异的临床数据及安全性。
LBL-034仅在GPRC5D+细胞存在时方会选择性地与T细胞结合,从而在有GPRC5D表达的肿瘤微环境中有条件地激活T细胞。在高、中及低GPRC5D表达细胞中,LBL-034表现出强大的剂量依赖性抗肿瘤活性,始终表现出优异的靶向细胞杀伤作用,凸显其作为优质治疗制剂的潜力。
该公司于2023年7月取得NMPA及FDA的IND批准,并于2023年11月在中国启动用于治疗多发性骨髓瘤(MM)的LBL-034单药疗法的I/II期研究。维立志博正在自主研发LBL-034,并拥有于全球开发及商业化LBL-034的权利。而强生旗下GPRC5D/CD3双抗Talquetamab,已于2023年8月10日,被FDA加速批准上市。
维立志博创始人、董事长、CEO康小强博士表示:“LBL-051为某些自身免疫性疾病提供了一种差异化的治疗选择,有望成为“Pipeline in a Product”的重磅革命性药物,我们很高兴能与Aditum 的高水平团队合作,将这一创新疗法带给全球患者。”
Aditum联合创始人兼董事总经理Joe Jimenez表示:“与单靶点疗法相比,LBL-051通过同时靶向CD19和BCMA,旨在实现“免疫重置”,为自身免疫性疾病患者提供了更深层次的应答和更持久的疗效。”
官网显示,维立志博创始人、董事长兼CEO康小强有16年以上抗体新药研发经验,曾任美国礼来制药首席科学家兼资深课题组长,参加过Erbitux的研发和成功上市。
另悉,Aditum Bio是一家生物技术风险投资公司,Oblenio Bio是Aditum Bio成立的第十三家公司。去年9月,创响生物曾宣布与Aditum Bio合作,共同创建Celexor Bio,该公司致力于开发治疗自身免疫和炎症疾病的新药。